下面几组物质,请将合适组号填写在下表中。
① 和
和 ;②
;② 和
和 ;③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和二甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3)。
;③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和二甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3)。
| 类别 |
同位素 |
同系物 |
同素异形体 |
同分异构体 |
| 组号 |
|
|
|
|
(16分)(1)Na2CO3固体中混有少量NaHCO3固体,除去的方法是___,化学方程式为_____________。
(2)NaHCO3溶液中混有少量Na2CO3,除去的方法是_______,反应的离子方程式为____________。
(3)NaOH溶液中混有少量Na2CO3,除去的方法是_________,反应的离子方程式为______________。
(4)CO2中混有少量的SO2,除去的方法是_________,反应的化学方程式为_____________。
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下: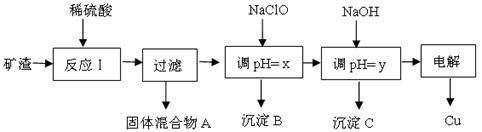
已知:Cu2O + 2H+ =" Cu" + Cu2+ + H2O
| 沉淀物 |
Cu(OH)2 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
| 开始沉淀pH |
5.4 |
4.0 |
1.1 |
5.8 |
| 沉淀完全pH |
6.7 |
5.2 |
3.2 |
8.8 |
(1)固体混合物A中的成分是。
(2)反应Ⅰ完成后,铁元素的存在形式为。(填离子符号)
请写出生成该离子的离子方程式。
(3)x、y对应的数值范围分别是、。
(4)下列关于NaClO调pH的说法正确的是。
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+ H+ HClO,ClO-消耗H+,从而达到调节pH的目的
HClO,ClO-消耗H+,从而达到调节pH的目的
c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+ H2O HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的。
HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的。
(5)用NaClO调pH,写出氯气制取漂白液的离子方程式:。
X~R是元素周期表中的短周期元素,其性质或结构信息如下表:
| 元素 |
X |
Y |
Z |
W |
R |
| 性质 信息 |
能形成+7价的化合物 |
日常生活中常见金属,熔化时并不滴落,好象有一层膜兜着 |
通常状况下能形成短周期中最稳定的双原子分子 |
焰色反应为黄色 |
位于第IVA,是形成化合物种类最多的元素 |
请用化学用语回答下列问题:
(1)X在元素周期表中的位置是_______。
(2)元素W的离子结构示意图为_________。
(3)元素R的最高价氧化物的电子式为_________。
(4)X的氢化物和Z的氢化物反应形成化合物A,A中含有的化学键类型为_____,_____。
(5)含Y的某化合物可用作净水剂,该物质的水溶液呈酸性,其原因是。(用离子方程式表示)
(6)W的氢氧化物是重要的基本化工原料。写出工业上制取该氢氧化物的离子反应方程式_____。
氨气是生产化肥、硝酸等的重要原料,围绕合成氨人们进行了一系列研究
(1)氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同。
(2)已知:2H2 (g) + O2 (g) = 2H2O (g)ΔH =" -483.6" kJ/mol
3H2 (g) + N2 (g)  2NH3 (g)ΔH =" -92.4" kJ/mol
2NH3 (g)ΔH =" -92.4" kJ/mol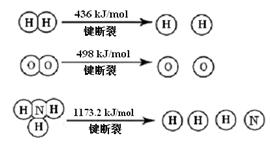
(1)计算断裂1 mol N≡N键需要能量kJ,氮气分子中化学键比氧气分子中的化学键键(填“强”或“弱”),因此氢气与二者反应的条件不同。
(2)固氮是科学家致力研究的重要课题。自然界中存在天然的大气固氮过程:
N2 (g) + O2 (g) =" 2NO" (g)ΔH =" +180.8" kJ/mol ,工业合成氨则是人工固氮。分析两种固氮反应的平衡常数,下列结论正确的是。
| 反应 |
大气固氮 |
工业固氮 |
||||
| 温度/℃ |
27 |
2000 |
25 |
350 |
400 |
450 |
| K |
3.84×10-31 |
0.1 |
5×108 |
1.847 |
0.507 |
0.152 |
A.常温下,大气固氮几乎不可能进行,而工业固氮非常容易进行
B.人类大规模模拟大气固氮是无意义的
C.工业固氮温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
(3)在恒温恒容密闭容器中按照甲、乙两种方式分别投料(物质的量如下表)所示,发生反应:3H2 (g) + N2 (g)  2NH3 (g)测得甲容器中H2的转化率为40%。
2NH3 (g)测得甲容器中H2的转化率为40%。
| N2 |
H2 |
NH3 |
|
| 甲 |
1 |
3 |
0 |
| 乙 |
0.5 |
1.5 |
1 |
①3H2 (g) + N2 (g) 2NH3 (g)的平衡常数表达式。
2NH3 (g)的平衡常数表达式。
②判断乙容器中反应进行的方向。(填“正向”或“逆向”)
(4)氨气是合成硝酸的原料,写出氨气与氧气反应生成一氧化氮和气态水的热化学方程式。
短周期元素Q、R、T、W在元素周期表中的位置如图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T的原子结构示意图为_______。
(2)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____。
(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是__________。
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的 =________(注:题中所设单质均为最稳定单质)。
=________(注:题中所设单质均为最稳定单质)。