(12分)牛奶放置时间长了会变酸,这是因为牛奶中含有不少乳糖,在微生物的作用下乳糖分解而变成乳酸。乳酸最初就是从酸牛奶中得到并由此而得名的。乳酸的结构简式为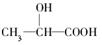 。完成下列问题:
。完成下列问题:
(1)写出乳酸分子中官能团的名称:________ ______。
(2)一定条件下乳酸能发生的反应类型有____ __ __(填序号)。
| A.水解反应 | B.取代反应 | C.加成反应 | D.中和反应 E.氧化反应 F.酯化反应 |
(3)写出乳酸与碳酸钠溶液反应的化学方程式:____________ _。
(4)乳酸在浓硫酸作用下,两分子相互反应生成链状结构的物质,写出此生成物的结构简式:____
(13分)平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵:
已知:
ⅰ.酸性条件下,铈在水溶液中有 、
、 两种主要存在形式,
两种主要存在形式, 易水解,
易水解, 有较强氧化性。
有较强氧化性。
ⅱ.CeO2不溶于稀硫酸
ⅲ.硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于水的净化处理。
(1).操作Ⅰ的名称是 ,检验硫酸铁铵溶液中含有NH4+的方法是: 。
(2).反应①之前先要洗涤滤渣B,其目的是为了除去 (填离子符号)。
(3).写出反应①的化学方程式 。
(4).用滴定法测定制得的Ce(OH)4产品纯度。
滴定时所用定量仪器的读数精确为 ;若所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”)
(5).称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应。则该硫酸铁铵的化学式为 。
【化学选修5——有机化学基础】
姜黄素(分子式为C21H20O6)存在姜科植物姜黄等的根茎中,具有抗基因突变和预防肿瘤的作用。其合成路线如下: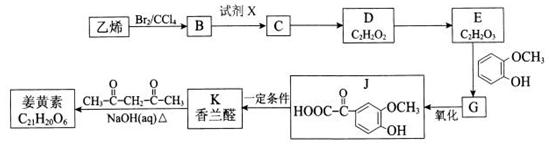
已知:
i.
ii.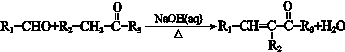
(R1、R2、R3为烃基或氢原子)
iii. E的核磁共振氢谱中有两个峰
请回答下列问题:
(1)E中含有的官能团名称是。
(2)B物质的名称为;试剂X为。
(3)姜黄素的结构简式为。
(4)E →G反应的化学方程式为;其反应类型是 。
(5)下列有关香兰醛的叙述正确的是(填正确答案编号)。
a.香兰醛能与NaHCO3溶液反应
b.香兰醛能与浓溴水发生取代反应
c.能与FeCl3溶液发生显色反应
d.1 mol香兰醛最多能与3 molH2发生加成反应
(6)符合下列条件的香兰醛(K)的同分异构体有种:①属于芳香族化合物 ②与氯化铁溶液发生显色反应 ③苯环上只有两个取代基 ④存在羰基的结构。写出香兰醛(K)的同分异构体中符合下列条件的结构简式。
①苯环上的一氯取代物只有2种;
②1mol该物质与烧碱溶液反应,最多消耗3molNaOH;
③核磁共振氢谱中有4种吸收峰。
乙醇、乙酸都是有机化工重要的基础原料。
(1).空气中,乙醇蒸气能使红热铜丝保持红热,该反应的化学方程式为。
(2).浓硫酸催化下,乙酸和乙醇生成乙酸乙酯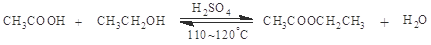

某化学兴趣小组的同学用以下装置进行该酯化反应的探究实验:
①要向大试管中加2mL浓硫酸、3mL乙醇、2mL乙酸,其具体操作是。
②小试管中装的是浓Na2CO3溶液,导气管不插入液面下是为了防止。
③相关物质的部分性质:
| 乙醇 |
乙酸 |
乙酸乙酯 |
|
| 沸点 |
78.0℃ |
117.9℃ |
77.5℃ |
| 水溶性 |
易溶 |
易溶 |
难溶 |
根据上表数据有同学提出可用水替代小试管中的Na2CO3溶液,你认为可行吗?说明理由:。④分离小试管中的乙酸乙酯应使用的仪器名称是;
⑤分离时,乙酸乙酯应该从仪器(填“下口放” 或“上口倒出”)。
⑥兴趣小组多次试验后,测出乙醇与乙酸用量和最后得到的乙酸乙酯生成量如下表:
| 实验序号 |
乙醇(mL) |
乙酸(mL) |
乙酸乙酯(mL) |
| a |
2 |
2 |
1.33 |
| b |
3 |
2 |
1.57 |
| c |
4 |
2 |
X |
| d |
5 |
2 |
1.76 |
| e |
2 |
3 |
1.55 |
表中数据X的范围是;实验a与实验e探究的目的是。
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
回答下列问题:
(1)加速卤块在H2O2溶液中溶解的措施有:(写出一条即可)。
(2)加入MgO的作用是;滤渣的主要成分为。
(3)向滤液中加入NaClO3饱和溶液后,发生反应的化学方程式为,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为①蒸发结晶;②;③____;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20.00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.l000 mol·L-1K2Cr2O7溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为: 。
。
步骤4:将步骤2、3重复两次,计算得平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式(还原产物为Cl-):;
②产品中Mg(ClO3)2·6H2O的质量分数为(保留一位小数)。
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
(1)甲烷燃料电池负极反应式是;
(2)石墨(C)极的电极反应式为;
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成的气体体积为________L ,丙装置中阴极析出铜的质量为________g ;
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。
若用于制漂白液,a为电池的________极,电解质溶液最好用________;若用于制Fe(OH)2,使用硫酸钠作电解质溶液,阳极选用________作电极。