随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点。“碳一化学”即以单质碳及CO、 、
、 、
、 等含一个碳原子的物质为原料合成工业产品的化学与工艺。
等含一个碳原子的物质为原料合成工业产品的化学与工艺。
(1)将 转化成有机物可有效实现碳循环。
转化成有机物可有效实现碳循环。 转化成有机物的例子很多,如:
转化成有机物的例子很多,如:
a. b.
b.
c. d.
d.
在以上属于人工转化的反应中,原子利用率最高的是 (填序号)。
(2)CO可用于合成甲醇。在压强0.1MPa条件下,在体积为bL的密闭容器中充入 和
和 ,在催化剂作用下合成甲醇:
,在催化剂作用下合成甲醇:

 。平衡时CO的转化率与温度、压强的关系如图。
。平衡时CO的转化率与温度、压强的关系如图。
①该反应属于 反应(填“吸热”或“放热”)。若一个可逆反应的平衡常数 值很大,对此反应的说法正确的是 (填序号)。
值很大,对此反应的说法正确的是 (填序号)。
a.反应使用催化剂意义不大
b.该反应发生将在很短时间内完成
c.该反应达到平衡时至少有一种反应物百分含量很小
d.该反应一定是放热反应
② 时,该反应的平衡常数
时,该反应的平衡常数 (用
(用 的代数式表示)。
的代数式表示)。
(3)二甲醚( )被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
)被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
①工业上利用水煤气合成二甲醚的三步反应如下:
a.



b.



c.



总反应:

 的
的 。
。
②对于反应b,在温度和容积不变的条件下,能说明该反应已达到平衡状态的是 (填字母)。
a.
b.容器内压强保持不变
c. 的浓度保持不变
的浓度保持不变
d. 的消耗速率与
的消耗速率与 的消耗速率之比为
的消耗速率之比为
(4)以KOH溶液为电解质,用二甲醚-空气组成燃料,其中负极的电极反应式为 。
(5)C1化合物在治理汽车尾气方面也大有可为,如CO、 等在一定条件下均可以与氮氧化物生成无污染的物质。写出CO与氮氧化物(NO
等在一定条件下均可以与氮氧化物生成无污染的物质。写出CO与氮氧化物(NO )在有催化剂的条件下反应的化学方程式
)在有催化剂的条件下反应的化学方程式
。
以锌锰废电池中的碳包(含碳粉、Fe、Cu、Ag和MnO2等物质 )为原料回收MnO2的工艺流程如下:
I.将碳包中物质烘干,用足量稀HNO3溶解金属单质,过滤,得滤渣a;
II. 将滤渣a在空气中灼烧除去碳粉,得到粗MnO2;
III.向粗MnO2中加入酸性H2O2溶液,MnO2溶解生成Mn2+,有气体生成;
IV. 向III所得溶液(pH约为6)中缓慢滴加0.50 mol•L-1 Na2CO3溶液,过滤,得滤渣b,其主要成分为MnCO3;
V. 滤渣b经洗涤、干燥、灼烧,制得较纯的MnO2。
(1)Ι中Ag与足量稀HNO3反应生成NO的化学方程式为 。
(2)已知II的灼烧过程中同时发生反应:
MnO2(s) + C(s) ="==" MnO(s) + CO (g)△H = +24.4kJ • mol –1①
MnO2(s) + CO(g) ="==" MnO(s) + CO2(g)△H = -148.1 kJ • mol –1②
写出MnO2和C反应生成MnO和CO2的热化学方程式: 。
(3)H2O2分子中含有的化学键类型为 、 。
(4)III中MnO2溶解的离子方程式为 ,溶解一定量的MnO2,H2O2的实际消耗量比理论值高,用化学方程式解释原因: 。
(5)IV中,若改为“向0.50 mol•L-1 Na2CO3溶液中缓慢滴加III所得溶液”,滤渣b中会混有较多Mn(OH)2沉淀,解释其原因: 。
(6)V中MnCO3在空气中灼烧的化学方程式为 。
某研究小组想研究碳与浓硝酸的反应。其实验过程如下。
| 操作 |
现象 |
 a.用干燥洁净的烧杯取约10 mL浓硝酸,加热。 a.用干燥洁净的烧杯取约10 mL浓硝酸,加热。 |
|
| b.把小块烧红的木炭迅速伸入热的浓硝酸中。 |
红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮。 |
(1)热的浓硝酸与红热的木炭接触会发生多个化学反应。
① 碳与浓硝酸的反应,说明浓硝酸具有性。
② 反应产生的热量会使少量浓硝酸受热分解,产生红棕色气体、一种无色无味的单质气体X和水,气体X的化学式是。
(2)实验现象中液面上木炭迅速燃烧,发出光亮。同学甲认为可能是木炭与气体X反应产生的现象;同学乙猜测NO2可能具有助燃性,木炭能在NO2中燃烧。他们设计了以下实验。
Ⅰ.制取NO2气体。
① 在虚线框内画出用铜与浓硝酸制取和收集NO2的装置简图(夹持仪器略)。
② NaOH溶液的作用是吸收多余的NO2,该反应生成两种物质的量相等的正盐,写出反应的化学方程式。
Ⅱ.探究实验。
实验操作:在空气中引燃木炭,使其燃烧并带有火焰,将带火焰的木炭伸入盛有NO2气体的集气瓶中。
实验现象:木炭在NO2气体中持续燃烧,火焰迅速变亮,集气瓶中气体颜色变浅直至无色,产生的气体能使澄清石灰水变浑浊,且遇空气不变色。
① 根据实验现象写出碳与NO2气体反应的化学方程式。
② 试分析是否需要增加带火焰的木炭与纯净的X气体反应的实验。
③ 通过实验探究,你认为甲、乙同学的预测是否合理,请简述理由。
空气吹出法是最早工业化海水提溴的方法,适合从低浓度含溴溶液中提取溴。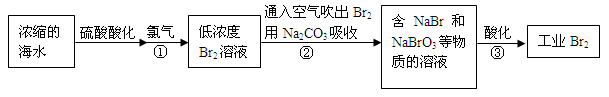
(1)NaBr的电子式是。
(2)反应①是将Br—转化为Br2,反应①的离子方程式是。
(3)通入空气吹出Br2,并用Na2CO3吸收的目的是。
(4)反应②的化学方程式是。
(5)反应③中每生成3 mol Br2,转移电子的物质的量是mol。
(6)为了除去工业Br2中微量的Cl2,可向工业Br2中(填字母)。
a.通入HBrb.加入NaBr溶液c.加入Na2CO3溶液d.加入Na2SO3溶液
硫化物在自然界中的部分循环关系如下。
(1)H2S在空气中可以燃烧。
已知: 2H2S(g) + O2(g) 2S(s) + 2H2O(g)ΔH= -442.38 kJ/mol①
2S(s) + 2H2O(g)ΔH= -442.38 kJ/mol①
S(s) + O2(g)  SO2(g)ΔH=-297.04 kJ/mol②
SO2(g)ΔH=-297.04 kJ/mol②
H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是。
(2)SO2是大气污染物,海水具有良好的吸收SO2的能力,其过程如下。
① SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32—,其电离方程式是。
② SO32—可以被海水中的溶解氧氧化为SO42—。海水的pH会(填“升高” 、“不变”或“降低”)。
③ 为调整海水的pH,可加入新鲜的海水,使其中的HCO3—参与反应,其反应的离子方程式是。
④ 在上述反应的同时需要大量鼓入空气,其原因是。
(3)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS),用化学用语表示由ZnS转变为CuS的过程:。
(4)SO2和O2在H2SO4溶液中可以构成原电池,其负极反应式是。
甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。
| 操作 |
现象 |
通入氯气至过量 |
I.A中溶液变红 II.稍后,溶液由红色变为黄色 |
(1)B中反应的离子方程式是______。
(2)A中溶液变红的原因是______。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在_______。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象II的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为  。
。
①甲同学认为SCN—中碳元素没有被氧化,理由是______。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是______。
③通过实验证明了SCN—中氮元素转化为,他的实验方案是______。
④若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是______mol。