甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。
| 操 作 |
现 象 |
通入氯气至过量 |
I.A中溶液变红 II.稍后,溶液由红色变为黄色 |
(1)B中反应的离子方程式是______。
(2)A中溶液变红的原因是______。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在_______。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象II的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为  。
。
①甲同学认为SCN—中碳元素没有被氧化,理由是______。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是______。
③通过实验证明了SCN—中氮元素转化为,他的实验方案是______。
④若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是______mol。
甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g)  CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
(1)下列措施中有利于增大该反应的反应速率的是_____________。
| A.随时将CH3OH与反应混合物分离 |
| B.降低反应温度 |
| C.增大体系压强 |
| D.使用高效催化剂 |
(2)乙醇燃料电池具有很高的实用价值。下图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。则该电池的负极反应式为。
(3)已知:CO(g)+1/2 O2(g)=CO2(g);△H2=-283 kJ·mol-1
H2(g)+1/2 O2(g)=H2O(g) △H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为
(4)在容积为2L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为2mol)与CO平衡转化率的关系。请回答: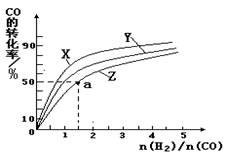
①在上述三种温度中,曲线Z对应是。
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g) CH3OH(g) 的平衡常数K =。
CH3OH(g) 的平衡常数K =。
纤维素是由很多单糖单元构成的,每一个单糖单元有三个醇羟基,因此纤维素能够表现出醇的一些性质,如生成硝酸酯、乙酸酯等。
(1)试写出生成纤维素硝酸酯和纤维素乙酸酯的化学方程式。
(2)工业上把酯化比较安全、含氮量高的纤维素硝酸酯叫做火棉,火棉可用来制造无烟火药,试简述可做火药的理由。
(3)纤维素乙酸酯俗名醋酸纤维,常用作电影胶片的片基。试分析醋酸纤维和硝酸纤维哪个容易着火,为什么?
用哪种试剂,可以把苯酚、乙醇、NaOH、KSCN四种溶液鉴别开来?现象分别是什么?
用一张滤纸浸湿些食盐水和酚酞试剂,放在表面皿上,滤纸两端用电极与直流电源相连,过一会发现其中一根导线连接的电极所接触的滤纸附近出现红色。简述出现红色的原因并指出该导线是直流电源的哪一极。
在氨的工业合成中,有三个关键的技术问题,请结合所学知识解决它们。
(1)合成氨的化学原理是N2+3H22NH3,在工业上选择20~50 MPa的较高压强和450 ℃左右的温度来进行反应,请结合有关的化学原理解释。
(2)在生产过程中需要大量氢气,现有以下几种获得氢气的方法,请你选出最适宜的,并说明理由。
A.电解水制取氢气
B.由煤或焦炭来制取氢气:煤或焦炭经加热,炽热的炭与水蒸气反应生成氢气
C.由天然气或重油制取氢气:天然气的主要成分甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳;一氧化碳在催化剂存在的条件下与水蒸气反应得到氢气和二氧化碳
(3)合成氨的生产工艺流程:首先用适当的方法生产出合成氨的原料气——氮气和氢气。氮气和氢气的混合气体在合成塔中于一定条件下,通过催化剂的作用产生氨气,再通过氨分离器不断地把生成的氨分离出来,同时未转化的反应气体再进入合成塔循环加工。这就是合成氨的工艺流程。请根据这一描述过程画出流程方框图。