铅蓄电池的工作原理为Pb+PbO2+2H2SO4====2PbSO4+2H2O,研读下图,下列判断不正确的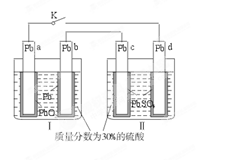
A.K闭合时,d电极反应式:PbSO4+2H2O-2e-====PbO2+4H++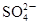 |
| B.当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol |
C.K闭合时,Ⅱ中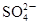 向c电极迁移 向c电极迁移 |
| D.K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极 |
某原电池的电池反应为Fe+2Fe3+====3Fe2+,与此电池反应不符合的原电池是( )
| A.铜片、铁片、FeCl3溶液组成的原电池 |
| B.石墨、铁片、Fe(NO3)3溶液组成的原电池 |
| C.铁片、锌片、Fe2(SO4)3溶液组成的原电池 |
| D.银片、铁片、Fe(NO3)2溶液组成的原电池 |
在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH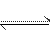 CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
| A.加入水时,平衡向逆反应方向移动 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)不变 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
氨分解反应(2NH3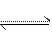 N2+3H2)在容积为2 L的密闭容器内进行,已知起始时氨气的物质的量为4 mol,5 s末为2.4 mol,则用氨气表示该反应的速率为( )
N2+3H2)在容积为2 L的密闭容器内进行,已知起始时氨气的物质的量为4 mol,5 s末为2.4 mol,则用氨气表示该反应的速率为( )
| A.0.32 mol·(L·s)-1 |
| B.1.6 mol·(L·s)-1 |
| C.0.16 mol·(L·s)-1 |
| D.0.8 mol·(L·s) -1 |
下列说法正确的是( )
| A.需要加热才能发生的反应一定是吸热反应 |
| B.放热反应在常温下一定很容易发生 |
| C.反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小 |
| D.吸热反应在一定条件下也能发生 |
溴化碘(IBr)的化学性质很像卤素的单质,它能与大多数金属、非金属化合生成卤化物,它也能与水发生以下反应:IBr+H2O====HBr+HIO。下列有关IBr的叙述不正确的是( )
| A.在很多反应中IBr是强氧化剂 |
| B.IBr与水反应时既作氧化剂,又作还原剂 |
| C.IBr与AgNO3溶液反应会生成AgBr沉淀 |
| D.IBr与NaOH溶液反应时,生成NaBr和NaIO |