4分)写出下列物质或原子团的电子式
(1)NaOH ;(2)C2H4 ;(3)CH3Cl ;(4)-OH 。
以五倍子为原料可制得A,A的结构简式如下图所示,试回答下列问题: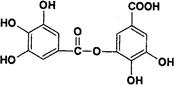
(1)A的分子式为_______________。
(2)有机化合物B在硫酸催化条件下加热发生酯化可得到A。则B的结构简式为______________。
(3)写出A与过量NaOH溶液反应的化学方程式__________________________________。
下列物质的类别与所含官能团都正确的是___________________。
选择适当试剂和操作方法除去下列物质中的少量杂质(括号内为杂质)
(1)乙烷(乙烯),试剂_______________操作方法_______________________________。
(2)苯(苯酚),试剂_________________操作方法_______________________________。
按要求完成下列问题:
(1)-CH2CH3:_________(名称);-NO2:_________(名称);苯酚:_________(俗称);
(2)乙炔:_____________(电子式);电石遇水可产生乙炔,其反应方程式为_____________________,乙炔可与HCl反应加成生成氯乙烯,在适当条件下,氯乙烯通过加聚反应生成聚氯乙烯的方程式为____________________________________________。
写出下列化学方程式,并标注反应类型
(1)苯酚与浓溴水反应_____________________________,反应类型__________________。
(2)丙烯与溴的四氯化碳溶液反应__________________________,反应类型____________。
(3)乙醛发生银镜反应____________________________________,反应类型____________。