已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:Cl-<Fe2+<H2O2<I-<SO2,则下列反应不能发生的是( )
A.2Fe3++SO2+2H2O = 2Fe2++SO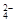 +4H+ +4H+ |
B.I2+SO2+2H2O = H2SO4+2HI |
| C.H2O2+H2SO4 = SO2↑+O2↑+2H2O | D.2Fe2++Cl2 = 2Fe3++2Cl- |
【改编】研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,正确的是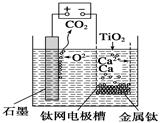
| A.由TiO2制得1 mol金属Ti,理论上外电路转移2 mol电子 |
| B.阳极的电极反应式为C+2O2--4e-==CO2↑ |
| C.在制备金属钛前后,整套装置中CaO的总量减少 |
| D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极 |
【原创】下列说法正确的是
| A.有机物的同系物具有相同的通式,且组成相差n(n>0的正整数)个亚甲基CH2原子团,因此等质量的同系物燃烧耗氧相差物质的量为1.5nmol |
| B.分子式为C7H16的有机物中有三种不同化学环境的氢原子,此有机物一定是2,4―二甲基戊烷或3,3―二甲基戊烷 |
C. 完全水解可以得到3种氨基酸 完全水解可以得到3种氨基酸 |
D.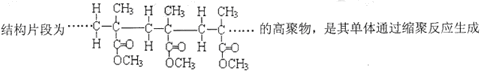 |
短周期元素A、B、C、D的原子序数依次递增,最外层电子数之和为14,A、C同主族,B、D也同主族,A、B在不同周期,X、Y均是由A、B、C、D四种元素组成的盐,X与Y相互作用,产生气体Z。下列说法正确的是
A.四种元素形成的简单离子半径按照D、C、B、A的顺序逐渐减小
B.A与其它元素形成的二元化合物的晶体类型相同
C.Z气体通入BaCl2溶液中无现象,再滴入FeCl3溶液则可看到有沉淀产生
D.将Z通入紫色石蕊试液中,试液先变红后褪色
【改编】下列说法正确的是
| A.用标准NaOH标准液滴定盐酸,尖嘴部位滴定前无气泡,滴定后有气泡,则滴定结果偏大 |
| B.受强酸或强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理 |
| C.比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度的盐酸反应速率快慢时,可以加K3[Fe(CN)6]溶液,观察铁钉周围出现蓝色沉淀的快慢 |
| D.自来水厂常用某些含铝或铁的化合物作净水剂,是由于这些物质具有杀菌消毒作用 |
【原创】下列说法正确的是
| A.用氨水法处理燃煤烟气中的二氧化硫,既可消除其污染,又可得到副产品硫酸铵 |
| B.光分解水制氢气、植物秸秆制沼气、高粱制乙醇都涉及到生物质能的利用 |
| C.赤铁矿、磁铁矿、黄铁矿、孔雀石都是常见的铁矿石 |
| D.肌红蛋白、蚕丝、过氧化氢酶、鱼肝油充分水解后均可得到氨基酸 |