在酸性溶液中能大量共存的离子组是( )
| A.Al3+、OH-、Na+ | B.K+、NO3-、Mg2+ |
| C.Ba2+、SO42-、Na+ | D.Ca2+、CO32-、Na+ |
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。下列“水” 电池在海水中放电时的有关说法正确的是
| A.每生成1 mol Na2Mn5O10转移2 mol电子 | B.正极反应式:Ag+Cl--e-=AgCl |
| C.Na+不断向“水”电池的负极移动 | D.AgCl是还原产物 |
如下图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是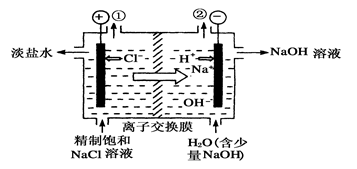
| A.装置中出口①处的物质是氯气,出口②处的物质是氢气 |
| B.装置中发生反应的离子方程式为:2Cl-+2H+通电Cl2↑+H2↑ |
| C.该装置是将电能转化为化学能 |
| D.该离子交换膜只能让阳离子通过,不能让阴离子通过 |
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 |
起始浓度/(mol·L-1) |
反应后溶液的pH |
|
| c(HA) |
c(KOH) |
||
| ① |
0.1 |
0.1 |
9 |
| ② |
x |
0.2 |
7 |
下列判断不正确的是
A.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)= mol/L
mol/L
B.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
下列溶液中离子浓度的关系一定正确的是
A.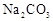 和 和 溶液中: 溶液中: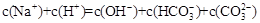 |
B.一元弱碱MOH对应的盐MCl溶液中: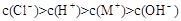 |
C.等物质的量的一元弱酸HX与其钾盐KX的混合溶液中: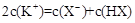 |
| D.pH=3的一元酸HX和pH=11的一元碱MOH等体积混合: |
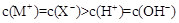
下列事实不能用平衡移动原理解释的是
| A.钢铁在潮湿的空气中比在干燥空气中更容易生锈 |
| B.用加热蒸干AlCl3溶液的方法不能制得无水AlCl3 |
| C.蒸馏水和0.1 mol•L-1 NaOH溶液中的c(H+),前者大于后者 |
| D.向含有少量Fe3+的MgCl2酸性溶液中加入MgCO3,可将Fe3+转化成Fe(OH)3除去 |