氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1 mol氢气中的化学键消耗的能量为Q1 kJ,破坏1mol氯气中的化学键消耗的能量为Q2 kJ,形成1mol氯化氢中的化学键释放的能量为Q3 kJ。下列关系式表述合理的是( )
| A.Q1-Q2>Q3 | B.Q1+ Q2>2Q3 | C.Q1+Q2<Q3 | D.Q1+ Q2<2Q3 |
如图,容器A左侧是可平行移动的活塞。向A中充入1molX的1molY,向B中充入2molX和2molY,起始时A、B的体积都等于a L。在相同温度、外界压强和催化剂存在的条件下,关闭活塞K,使两容器中各自反应:X (g)+ Y(g) 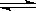 Z(g)+2W(g)。达平衡时,A的体积为1.2 a L 。下列说法正确的是
Z(g)+2W(g)。达平衡时,A的体积为1.2 a L 。下列说法正确的是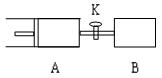
A.反应速率:v(B) >v(A)
>v(A)
B.A容器中X的转化率为 20%
C.平衡时的压强:PB=2PA
D.若打开K,则达到新的化学平衡时,A的体积为2.6a L
下列各溶液中,微粒的物质的量浓度关系正确的是
| A.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-) |
| B.在0.1mol·L-1Na2CO3溶液中:c(OH—)==c(HCO3—)+c(H+)+ c(H2CO3) |
| C.pH>7的NaCN与HCN的混合溶液中一定有:c(Na+)>c(CN-) >c(OH—) >c(H+) |
| D.pH>7的CH3COONa与NaOH的混合溶液中一定有:c(Na+)>c(CH3COO—) >c(OH—) >c(H+) |
已知反应AsO43—+2I—+2H+ AsO33—+I2+H2O是可逆反应。设计如图装置(盐桥中的阴、阳离子可以自由移动,盐桥在原电池中不参与反应,只起导体作用),分别进行下述操作:(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,(Ⅱ)向(B)烧杯中逐滴加入40%NaOH溶液。结果均发现电流计指针偏转。据此,下列判断正确的是
AsO33—+I2+H2O是可逆反应。设计如图装置(盐桥中的阴、阳离子可以自由移动,盐桥在原电池中不参与反应,只起导体作用),分别进行下述操作:(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,(Ⅱ)向(B)烧杯中逐滴加入40%NaOH溶液。结果均发现电流计指针偏转。据此,下列判断正确的是
A.两次操作过程中指针偏转方向相同
B.两次操作过程中指针偏转方向相反
C.(Ⅰ)操作过程中C2棒上发生的反应为:AsO43—+2e—+2H+= AsO33—+H2O
D.(Ⅱ)操作过程中C1棒上发生的反应为:2I——2e— = I2
甲、乙、丙、丁为短周期元素形成的粒子,它们的电子总数相等。已知四种粒子中,甲、乙为分子,丙为双原子构成的负二价阴离子,丁为原子。则下列说法正确的是
| A.丙与钙离子组成的化合物为离子化合物 |
| B.丁原子一定是稀有气体原子 |
| C.甲、乙的分子中可能有非极性分子 |
| D.丙与钙离子组成的化合物和水反应生成的气体一定是乙炔 |
如图为某有机物的结构简式,每个节点处代表有一个碳原子,与其结合的氢原子的元素符号省略,这种化学式称为“键线式”。又知酯类在铜铬氧化物(CuO·CuCrO4)催化下,与氢气反应得到醇,羰基双键可同时被还原,但苯环在催化氢化过程中不变,其反应原理如下:
关于该化合物的下列说法中,正确的是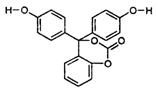
| A.该有机物的化学式为C20H14O5 |
| B.1mol该有机物与浓溴水反应,消耗5molBr2 |
| C.与足量氢氧化钠溶液充分反应,所得产物中相对分子质量较小的钠盐为HCOONa |
| D.1mol该有机物在铜铬氧化物催化下能与2mol氢气发生反应 |