卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。对于过氧化钙(CaO2)的叙述错误的是( )
| A.CaO2具有氧化性,对面粉可能具有增白作用 |
| B.CaO2中阴阳离子的个数比为1:1 |
| C.CaO2和水反应时,每产生1 mol O2转移电子4 mol |
| D.CaO2和CO2反应的化学方程式为:2CaO2 +2CO2 =2CaCO3+O2 |
下列实验过程中,始终无明显现象的是( )
| A.NO2通入FeSO4溶液中 | B.CO2通入CaCl2溶液中 |
| C.NH3通入AlCl3溶液中 | D.SO2通入已酸化的Ba( NO3 )2溶液中 |
下列实验装置设计正确、且能达到目的的是 ()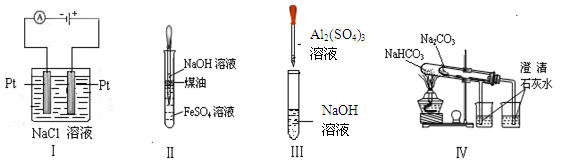
| A.实验Ⅰ:制备金属钠 | B.实验Ⅱ:制取氢氧化亚铁并观察其颜色 |
| C.实验Ⅲ:制取少量的氢氧化铝 | D.实验Ⅳ:比较两种物质的热稳定性 |
在含有Fe3+、Fe2+、Al3+、NH4+的稀溶液中,加入足量的Na2O2固体并微热,充分反应后,再加入过量的稀盐酸,完全反应后,离子数目没有明显变化的是( )
| A.Fe3+ | B.Fe2+ | C.NH4+ | D.Al3+ |
下列关于化学反应的描述中正确的是( )
| A.需要加热才能发生的反应一定是吸热反应 |
| B.已知NaOH(aq) +HCI(aq) =NaCI(aq)+H2O(1)△H="-57.3" kJ·mol-1, 则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量 |
| C.CO(g)的燃烧热是283.0 kJ·mol-1,则表示CO(g)的燃烧热的热化学方程式为 2CO(g)+O2(g)=2CO2(g)△H="-283.0" kJ·mol-1 |
| D.已知2C(s) +2O2(g)=2CO2(g)△H=a,2C(s) +O2(g)=2CO(g)△H=b,则b>a |