煤炭可以转化为清洁能源和化工原料。
(1)用煤可以制得水煤气。工业上可用煤和水通过水煤气法制氢气,已知下列热化学方程式:
C(s)+ O2(g)=CO(g)
O2(g)=CO(g) 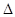 H1=-110.5 kJ/mol
H1=-110.5 kJ/mol
2H2(g)+O2(g)=2H2O(g) 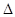 H2=-483.6 kJ/mol
H2=-483.6 kJ/mol
试求水煤气法制氢气的反应的反应热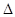 H3。
H3。
C(s)+H2O(g)=CO(g)+H2(g)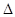 H3= kJ/mol
H3= kJ/mol
(2)已知一氧化碳与水蒸气反应过程的能量变化如下图所示:则此反应为 (填“吸热”或“放热”)反应,反应的热化学方程式为 。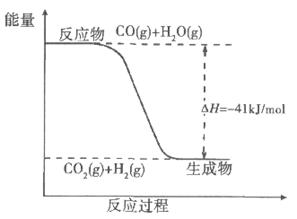
(16分) 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g) 2SO3(g)ΔH=-190kJ·mol-1
2SO3(g)ΔH=-190kJ·mol-1
(1)该热化学反应方程式的意义是_______________________________________________
升高温度上述反应平衡常数____(填“变大”“变小”或“不变”)。
(2)下列描述中能说明上述反应已达平衡的是________。
a.v(O2)正=2v(SO3)逆
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(3)在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol,则v(O2)=__________mol·L-1·min-1;若继续通入0.20 mol SO2和0.10 mol O2,则平衡________________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol<n(SO3)<________mol。
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子。使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示。请认真观察下图,然后回答问题。
(1)图中反应是(填“吸热”或“放热”)反应,该反应(填“需要”或“不需要”)环境先提供能量,该反应的△H=(用含E1、E2的代数式表示)。
(2)对于同一反应,图中虚线(II)与实线(I)相比,活化能,因此反应速率,你认为最可能的原因是:。
(3)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为:____________________
化学提高了人们生存的质量,生活质量的提高又促进了化学发展。
(1)下列说法错误的是( )
A.药片变色、潮解,则不宜服用
B.复方氢氧化铝片常用来治疗胃酸过多症
C. “药是三分毒”,因此,有病不要服药
D.实行“食盐加碘”是控制碘缺乏症的有效途径之一
(2)下列做法中错误的是( )
A.鱼、肉、虾等食品用福尔马林防腐保鲜
B.国际奥委会禁止使用的兴奋剂——麻黄碱
C.向伤口处涂一定浓度的双氧水溶液可以杀菌消毒
D.误食铜、汞、铜等重金属,立即喝牛奶或鸡蛋清解毒
(3)肉类如果长时间接触空气,其红色就会被氧化成难看的棕色,如果加入亚硝酸钠,就可以使肉保持鲜红,这是利用了亚硝酸钠的什么性质( )
A.氧化性 B.还原性 C.防腐 D.着色
(4)环境污染已成为人类社会面临的重大威胁,各种污染数不胜数,下列各项中与环境污染无关的是( )
①温室效应 ②赤潮 ③酸雨 ④臭氧空洞
⑤水俣病 ⑥大脖子病 ⑦水华⑧潮汐
A.①② B.③④ C.⑤⑥ D.⑥⑧
下列是元素周期表的短周期中的部分元素
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
A |
|||||||
| 2 |
B |
C |
D |
E |
||||
| 3 |
F |
G |
H |
I |
L |
(1)表中元素,原子半径最大的是________,原子半径最小的是________。(不包括稀有气体元素。填空均用元素符号或化学式回答,下同)
(2)金属性最强的是;化学性质最不活泼的是;最高正价和负价的绝对值相等的是;氢化物水溶液呈碱性的是。
(3)I和L最高价氧化物对应的水化物酸性较强的是,判断依据之一是
现有一包AlCl3和FeCl3的混合粉末,欲将其中的Al元素和Fe元素分开,可进行如下操作:
(1) 操作①名称是,操作②名称是(过滤/分液/蒸馏/溶解/结晶);
(2)溶液B是,沉淀C是
(3)若往溶液A中滴入KSCN溶液,预计会观察到溶液呈色;
(4)请写出在溶液中,FeCl3和NaOH反应的离子方程式: