常温下,两种溶液:①0.1 mol/L HAC ②0.1 mol/L NaAC。
(1)溶液①的pH 7(填“>”、“<”或“=”),溶液中离子的电荷守恒的关系式是 。
(2)溶液②呈 性(填“酸”、“碱”或“中”)。其原因是 (用离子方程式表示)。
(3)两种溶液中c(AC-)的大小为 (填序号)。
a. 两种溶液中c(AC-)都等于0.1 mol/L
b. 两种溶液中c(AC-)都小于0.1 mol/L
c. HAC溶液中c(AC-)小于NaAC溶液中c(AC-)
(4)若将①②两溶液按一定的量混合,混合后溶液显中性,则①②两溶液的体积关系是:① ②(填“=”或“>”或“<”)
某金属A及其化合物之间有如下的转化关系: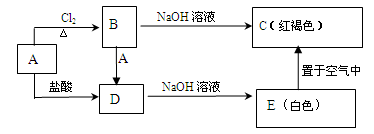
试回答下列问题:
(1)D的溶液与NaOH 溶液混合后的现象是
。
(2)反应B转化成D的离子方程式是。
(3)把B溶液滴入沸水中可以得到红褐色的液体,用一束光通过该液体产生。
(6分)氯水中含有多种成分,因而具有多重性质,根据氯水分别与如图四种物质发生的反应,填空(a、b、c、d重合部分代表物质间反应,且氯水足量)。
(1)能证明氯水具有漂白性的是__________(填“a”、“b”、“c”或“d”)。
(2)C过程中的现象是_______________________,b过程中的离子方程式为______________________。
(3)a过程中的化学方程式为_____________________________。
氯酸钾与浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,反应的化学方程式为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O↑
(1)用双线桥表示上述反应中电子转移的方向和数目。
(2)浓盐酸在该反应中表现的性质是_______________(填序号)。
①只有还原性②还原性和酸性③只有氧化性④氧化性和酸性
(3)上述反应产生0.1molCl2时,转移的电子数为_____________。
(6分)如图A、B、C、D、E各代表铁、水、三氧化硫、盐酸和氢氧化钡中的一种物质。在常温下,相连环物质之间能发生反应,不相连环物质之间不能发生反应。且B的相对分子质量小于D。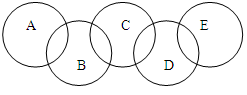
(1)五中物质中属于氧化物的有(填化学式)。
(2)请写出氢氧化钡的电离方程式。
(3)请写出铁与水蒸汽在高温下发生反应的化学方程式
。
(4)请写出下列物质的化学式:B,D(填化学式)。
(4分)选择下列实验方法分离物质,将分离方法的序号填在横线上:
| A.过滤 | B.结晶 | C.分液 | D.蒸馏 E.萃取分液 F.升华 |
(1)分离水和四氯化碳的混合物;
(2)从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
(3)分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)的混合物;
(4)从碘水中提取碘单质。