A、B、C、D为原子序数依次增大的四种短周期元素,其性质或结构信息如下表:
| 元素 |
A |
B |
C |
D |
E |
| 性质 或结 构信 息 |
室温下单质呈气态,原子最外层电子数与D相同 |
D3B中阳离子与阴离子的电子层结构相同 |
A和C可形成两种常见的化合物甲和乙,甲有强氧化性 |
单质质软、银白色固体、导电性强,在空气中燃烧生成淡黄色固体 |
E的气态氢化物和最高价氧化物对应的水化物均为强酸,C、D和E三种元素形成的一种盐丙为某消毒液的主要成分 |
试回答以下问题
(1)B在周期表中的位置是 ,B的氢化物与E的氢化物比较,沸点较高的是 (填化学式)。
(2)D3B可与水反应生成2种碱性物质,请写出这一化学方程式 。
(3)写出丙的电子式为 。说明丙在空气中漂白的原理(用化学方程式表示) 。(请参考下表数据)
| 酸 |
电离常数 |
| HClO |
Ka=3.0×10-8 |
| H2CO3 |
Ka1=4.3×10-7,Ka2=5.6×10-11 |
(4)由B、C、D四种元素中的三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈碱性。将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成蓝色溶液,写出该反应的离子方程式 。
根据下表所示化学反应与数据关系:
| 化学反应 |
平衡常数 |
温度 |
|
| 973K |
1173K |
||
① |
 |
1.47 |
2.15 |
② |
 |
2.38 |
1.67 |
③ |
 |
? |
? |
请回答:
(1)反应①是 (填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(3)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有 (填写字母序号)。
A缩小反应容器的容积B扩大反应容器的容积 C升高温度
D使用合适的催化剂 E设法减小平衡体系中的CO的浓度
(4)若反应③的逆反应速率与时间的关系如图所示:
①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时 ,t8时 。
②若t4时降压,t6时增大反应物的浓度,请在图中画出 ~
~ 时逆反应速率与时间的关系线。
时逆反应速率与时间的关系线。
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Na+、K+、Cu2+ |
| 阴离子 |
SO42—、OH— |
如图1中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了16g。常温下各烧杯中溶液的pH与电解时间t的关系如图2。据此回答下列问题:
(1)电极b上发生的电极反应为 。
(2)写出乙烧杯的电解池总反应化学方程式 。
(3)用惰性电极电解B溶液,当阳离子浓度下降至一半时停止通电,加入下列物质不能使该溶液恢复至起始状态的是 。
A、Cu2O B、CuO C、Cu(OH)2D、CuCO3
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行 (填“能”或“不能”)。
(5)计算电极e上生成的气体在标准状态下的体积 。
(6)要使丙烧杯溶液恢复到原来的状态,操作是 。
工业上用某矿渣(主要成分是Cu2O,少量杂质是Al2O3、Fe2O3和SiO2)提取铜的操作流程如下: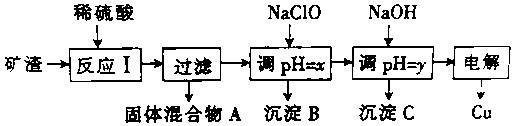
已知:Cu2O+2H+==Cu+Cu2++H2O
| 沉淀物 |
 |
 |
 |
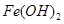 |
| 开始沉淀pH |
5.4 |
4.0 |
2.2 |
5.8 |
| 沉淀完成pH |
6.7 |
5.2 |
3.2 |
8.8 |
(1)固体混合物A中的成分是 (填化学式)。
(2)反应I完成后,铁元素的存在形式为 (填离子符号)。
(3)y的数值范围是 。
(4)若电解法获得Cu 64.0g,则原矿渣中Cu2O的质量是 。
a、144.0gb、大于144.0gc、小于144.0g
(5)下列关于用NaClO调节溶液pH的说法正确的是 。
a、加入NaClO可使溶液的pH降低
b、NaClO能调节pH的主要原因是由于发生反应: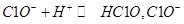 消耗H+,从而达到调节pH的目的
消耗H+,从而达到调节pH的目的
c、NaClO能调节pH的主要原因是由于NaClO水解: OH—消耗H+,从而达到调节pH的目的。
OH—消耗H+,从而达到调节pH的目的。
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,且该物质与还原产物的物质的量之比为4:1,该反应的离子方程式为 。
已知由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示,B、X为单质,D常温下为无色液体,A、B含同一种元素。(某些产物可能略去)
请回答下列问题:
(1)若E是有色气体,F是一元强酸,反应①是工业制备F的第一步反应。
①写出A与X反应的化学方程式: 。
②A的分子结构模型为 。
③已知常温下46g气体E发生反应③放出46kJ热量,写出气体E与H2O反应的热化学方程式 。
④在常温下,向V1LpH=a的A溶液中加入V2LpH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则V1和V2的关系为V1 V2(填 无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是 。(写出一种情况即可)
无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是 。(写出一种情况即可)
(2)若E为无色无味气体,F是二元弱酸。
①E的电子式为 ;
②将少量气体E通入氢氧化钡溶液中得不溶物H,H的Ksp=8.1×10—9。现将该沉淀放入0.1mol/L的BaCl2溶液中,其Ksp ,(填:增大、减小或不变),此时,组成不溶物H的阴离子在溶液中的浓度为 mol/L。
已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且 的值与温度高低有关.当n(KOH)="a" mol时,
的值与温度高低有关.当n(KOH)="a" mol时,
(1)标准状况下,参加反应的氯气的体积等于 L
(2)若某温度下,反应后 ,则溶液中
,则溶液中 = ,此时反应总离子方程式为 .
= ,此时反应总离子方程式为 .
(3)改变温度,产物中KClO3的最大理论产量为 mol.