I.在温度为T时,向2.0 L恒容密闭容器中充入1.0 mol A和1.0 mol B,发生反应A(g)+B(g)  C(g),一段时间后达到平衡。测定得部分数据见下表:
C(g),一段时间后达到平衡。测定得部分数据见下表:
| t/s |
0 |
5 |
15 |
25 |
35 |
| n(A)/mol |
1.0 |
0.85 |
0.81 |
0.80 |
0.80 |
回答下列问题:
(1)反应前5 s的平均反应速率v(A) =____________
(2)温度为T时,该反应的化学平衡常数=
(3)升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH (填 “>0” 或 “<0”)
(4)相同温度下,起始时向容器中充入0.2 mol A、0.2 mol B和1.0 mol C,反应达到平衡前,反应速率v正 v逆(填“>” 或 “<”)
(5)下列措施能增大反应速率,且平衡往正反应方向移动是 。
a.及时分离出A气体
b.适当升高温度
c.增大B的浓度
d.选择高效催化剂
II.NO、NO2是常见的氧化物。用H2或CO催化还原NO可达到消除污染的目的。
已知:2NO(g) = N2(g) + O2(g) △H = -180.5kJ·mol-1
2H2O(l) = 2H2(g) + O2(g) △H = +571.6kJ·mol-1
则用H2催化还原NO消除污染的热化学方程式是
实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(1)在该反应中,氧化剂是,如有1 mol Cl2生成,被氧化的HCl的物质的量是mol,转移电子的物质的量是mol;
(2)将制得氯气通入冷的消石灰[Ca(OH)2]中即可制得漂白粉,其反应的化学方程式是;在某温度下,将Cl2通入浓NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,此反应的化学方程式是;
(3)进行有关氯气的性质实验时,需2.24 L的氯气(标准状况),理论上需要MnO2固体的质量为
g。(浓盐酸足量)
(4)前段时间,报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)。
短周期元素X、Y、Z在周期表中位置关系如图所示
(1)X元素的名称是___________。
(2)Y在元素周期表中的位置是__________,它形成单质的化学式是_________。
(3)Z元素的原子结构示意图为__________。写出Z单质与铁反应的化学反应方程式:___________。
已知 可简写为
可简写为 ,降冰片烯的分子结构可表示为:
,降冰片烯的分子结构可表示为:
(1)降冰片烯属于。
A.环烃 B.不饱和烃 C.烷烃 D.芳香烃
(2)降冰片烯的分子式为____________.
(3)降冰片烯的一种同分异构体(含有一个六元环的单环化合物)的结构简式为_______.
(4)降冰片烯不具有的性质是。
A.能溶于水B.能发生氧化反应
C.能发生加成反应D.常温常压下为气体
下图中的实验装置可以用于实验室制取乙炔。请填空:
(1)图中A管的作用是,制取乙炔的化学反应方程式为。
(2)乙炔通入酸性KMnO4溶液中,发生反应,可以观察到的现象为,
若通入溴水中,发生反应,反应方程式为。
(3)乙炔燃烧的化学方程式为,燃烧时的现象为,
为了安全,点燃乙炔前应该先。
已知下列物质:①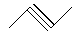 ,②
,② ,③
,③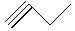 ,④
,④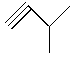 ,⑤
,⑤
请按要求填空:
(1)写出①④的名称________、________;
(2)写出②、⑤的分子式________、________;
(3)互为同分异构体的是________;互为同系物的是_______
(4)写出③与等物质的量的Br2反应的化学方程式:_____________________。