A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1mol/L。反应进行2min后A的浓度为0.8mol/L,B的浓度为0.6mol/L,C的浓度为0.6mol/L。则2min内反应的平均速率(1)VA=__________,(2)VB =__________,(3)VC =___________。(4)该反应的化学反应方程式为___________________________。
有以下四种物质:①22 g二氧化碳②8 g氢气③1.2×10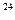 个氮气分子④4 ℃时18 mL水。它们所含分子数最多的是,所含原子数最多的是,质量最大的是,所含电子数最多的是(填序号)
个氮气分子④4 ℃时18 mL水。它们所含分子数最多的是,所含原子数最多的是,质量最大的是,所含电子数最多的是(填序号)
经实验测定,在4 ℃时,水的密度最大,为1 g·mL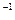 ,请计算一下,4 ℃时1 L水中含有的水分子数为,每个水分子的质量为。
,请计算一下,4 ℃时1 L水中含有的水分子数为,每个水分子的质量为。
有一种可溶性氯化物、溴化物、碘化物的混合物,对其进行如下测定:
①称取试样5.00 g,溶于水后加入足量AgNO3溶液,使卤离子完全沉淀为卤化银,质量为3.57 g。将该卤化银加热并通入氯气使AgBr、AgI完全转化为AgCl后,其质量变为2.87 g。
②称取试样15.00 g,溶于水后加入氯化亚钯(PdCl2)处理后,其中只有碘化物转化为PdI2沉淀,该沉淀的质量为2.16 g。
请完成下列问题:
(1)步骤①称取的试样中,所有卤原子的物质的量之和是_____________mol,该试样中碘原子的物质的量是______________mol。
(2)列式计算原混合物中溴的质量分数和氯的质量分数
将一定量的NaOH和NaHCO3的混合物放在密闭的容器中加热,充分反应后生成CO2的体积为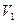 (
(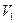 ≠0)。将反应后的固体残渣Y与过量的稀盐酸反应,又生成
≠0)。将反应后的固体残渣Y与过量的稀盐酸反应,又生成 体积的CO2(
体积的CO2(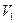 、
、 均为标准状况时的体积)。
均为标准状况时的体积)。
(1)Y的主要成分是_________(写化学式)。
(2)求原混合物中NaOH的NaHCO3的物质的量之比。
(9分)用下列数据求氧原子的电子亲和能
Mg(s) Mg(g)ΔH1="141" kJ·mol-1
Mg(g)ΔH1="141" kJ·mol-1
Mg(g) Mg2+(g)ΔH2="2" 201 kJ·mol-1
Mg2+(g)ΔH2="2" 201 kJ·mol-1 O2
O2 O(g)ΔH3="247" kJ·mol-1
O(g)ΔH3="247" kJ·mol-1
Mg2+(g)+O2-(g) MgO(s)ΔH4="-3" 916 kJ·mol-1
MgO(s)ΔH4="-3" 916 kJ·mol-1
Mg(s)+ O2(g)
O2(g) MgO(s)ΔH5="-602" kJ·mol-1
MgO(s)ΔH5="-602" kJ·mol-1