某化学兴趣小组同学为测定锌铜合金中锌的质量分数,称取8.0克合金样品,将60.0克稀硫酸分6次加入样品中,充分反应后过滤、洗涤、干燥、称量.得到实验数据如下.
| 稀
用量 |
剩余固体质量 |
| 第一次加入10.0克 |
|
| 第二次加入10.0克 |
5.4克 |
| 第三次加入10.0克 |
4.1克 |
| 第四次加入10.0克 |
2.8克 |
| 第五次加入10.0克 |
1.6克 |
| 第六次加入10.0克 |
1.6克 |
(1)表格中,
克.
(2)该锌铜合金锌的质量分数为.
(3)计算所用稀
中溶质的质量分数.(请写出计算过程,结果精确到0.1%)
现有HCl与CaCl2的混合溶液,为了分析混合溶液中HCl和CaCl2的质量分数,设计了如下实验方案:
【实验数据】实验共记录了两组数据:第①组,气体吸收完全后,NaOH溶液质量增加4.4 g;第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为10 g。
根据实验设计及有关数据进行分析与计算:
(1)混合溶液中HCl的质量分数为__________。(只写结果)
(2)混合溶液中CaCl2的质量分数为多少?(写出计算过程)
(3)实验中混合溶液与Na2CO3溶液恰好完全反应,经过滤后所得滤液中溶质的质量分数为__________。(不考虑过滤中的损失。只写结果,保留至小数点后一位)
(4)若在100 g混合溶液中不断加入10.6% 的Na2CO3溶液,请你画出加入Na2CO3溶液的质量与产生沉淀的质量的关系图。
某同学为验证质量守恒定律,向烧杯中加入40g溶质质量分数为20%的硫酸铜溶液,另取两只试管,向其中一只试管中加入一定质量的氢氧化钠溶液,向另一只试管中加入足量的稀硫酸。
第一步:如图所示,将试管放入烧杯中并在天平上称重。
第二步:先将氢氧化钠溶液倒入烧杯中,能观察到的反应现象是;随后再将足量的稀硫酸倒入烧杯中,能观察到的反应现象是。
第三步:将两只试管放回烧杯中,并将烧杯重新放在天平的左盘上,能观察到天平指针(填“偏左”、“偏右”或“保持不变”)。
计算:若使硫酸铜溶液与氢氧化钠溶液恰好完全反应,计算参加反应的氢氧化钠溶液中溶质的质量。
将一定质量的甲烷和一氧化碳的混合气体在足量的氧气中充分燃烧,将生成物依次通入盛有足量浓硫酸和氢氧化钠溶液的洗气瓶,实验测得装有浓硫酸的洗气瓶增重5.4克,装有氢氧化钠溶液的洗气瓶增重8.8克。试计算:
(1)混合气体中甲烷的质量(写出完整的计算过程)
(2)混合气体中甲烷和一氧化碳的质量之比为___________,混合气体中碳、氢、氧三种元素的质量之比为_________________。
氢气在氯气中燃烧生成氯化氢气体。计算燃烧20g氢气需要氯气的质量是多少?生成氯化氢气体的质量是多少?(写出计算过程)
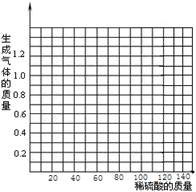
黄铜是一种重要的金属,它是铜和锌的合金,可用来制造机器、电器零件及日常用品。为了测定黄铜样品的组成,取五份样品分别加稀硫酸反应,其实验数据记录如下:
| 样品 |
第1份 |
第2份 |
第3份 |
第4份 |
第5份 |
| 取样品质量(g) |
40.0 |
40.0 |
40.0 |
40.0 |
40.0 |
| 取稀硫酸质量(g) |
30.0 |
60.0 |
90.0 |
120.0 |
150.0 |
| 产生气体质量(g) |
0.3 |
0.6 |
0.9 |
1.0 |
1.0 |
按要求回答下列问题:
(1)根据实验数据分析,从第份开始,金属已经反应完全了。
(2)列式计算该黄铜样品中金属锌的质量分数。(要求写出计算过程)
(3)在给出的坐标纸上,画出40.0g样品中加稀硫酸的质量与产生气体质量的关系曲线。