由短周期元素构成的离子化合物中,一个阳离子和一个阴离子的核外电子数之和为20,下列说法中正确的是
| A.晶体中阳离子半径一定大于阴离子半径 |
| B.晶体中一定只含有离子键而没有共价键 |
| C.所含元素一定不在同一周期也不在第一周期 |
| D.晶体中阳离子和阴离子个数不一定相等 |
下列说法正确的是( )
| A.同温同压下,H2 + Cl2 = 2HCl在光照和点燃条件的△H不同 |
| B.粗铜精炼时,与电源负极相连的是粗铜 |
| C.船底镶嵌锌块,锌作负极,以防船体被腐蚀 |
| D.天然气、沼气和水煤气分别属于化石能源、可再生能源和一级能源 |
下列有关叙述正确的是( )
A.硫原子的原子结构示意图: |
B.过氧化钠的电子式:Na+[     ]2- Na+ ]2- Na+ |
C.原子核内有8个质子、10个中子的氧原子: |
D. 和 和 互为同位素 互为同位素 |
下列对化学反应的认识错误的是( )
| A.会引起化学键的变化 | B.会产生新的物质 |
| C.必然引起物质状态的变化 | D.必然伴随着能量的变化 |
在一定温度下,容器内某一反应中M.N的物质的量随反应时间变化的曲线如图,下列表述中正确的是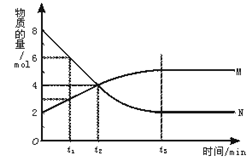
A.反应的化学方程式为: N 2M 2M |
| B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时,N的浓度是M浓度的2倍 |
可逆反应∶2NO2 2NO+O2在恒容密闭容器中反应,达到平衡状态的标志是 ( )
2NO+O2在恒容密闭容器中反应,达到平衡状态的标志是 ( )
| A.单位时间内生成n molO2的同时生成2n molNO |
| B.用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态 |
| C.混合气体的密度不再改变的状态 |
| D.混合气体的平均相对分子质量不再改变的状态 |