下列热化学方程式正确的是(△H的绝对值均正确)( )
| A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)△H=" -1367.0" kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H= +57.3kJ/mol(中和热) |
| C.S(s)+O2(g)=SO2(g)△H= -269.8kJ/mol(反应热) |
| D.2NO2=O2+2NO△H=+116.2kJ/mol(反应热) |
一定温度下可逆反应N2(g) + 3H2(g) 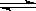 2NH3(g) 达平衡的标志是
2NH3(g) 达平衡的标志是
| A.v正(N2) = v逆(NH3) | B.v正(N2) = 3v正(H2) |
| C.v正(H2) =" 3/2" v逆(NH3) | D.N2、H2、NH3的体积比为1︰3︰2 |
在反应3H2+N2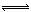 2NH3中,经一段时间后,氨的浓度增加了0.6 mol/L,在此时间内用H2表示的平均反应速率为O.45 mol/(L·s),则反应所经历的时间为
2NH3中,经一段时间后,氨的浓度增加了0.6 mol/L,在此时间内用H2表示的平均反应速率为O.45 mol/(L·s),则反应所经历的时间为
| A.0.44 s | B.1 s | C.O.33 s | D.2 s |
钠和铯都是碱金属元素,下列关于铯及其化合物的叙述中不正确的是
| A.硫酸铯的化学式为Cs2SO4 |
| B.氢氧化铯是一种强碱 |
| C.碳酸铯受热易分解成氧化铯和二氧化碳 |
| D.铯的熔沸点比钠的低 |
图中每条折线表示周期表ⅣA~ⅦA族中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是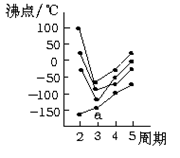
| A.H2S | B.HCl |
| C.SiH4 | D.PH3 |
已知N2--阴离子的核内有X个中子,其质量数为A,则mg该离子含电子的物质的量为
| A.m(A-X)/A mol | B.m(x+2)/A mol |
| C.m(A-X+2)/A mol | D.m(A-X-2)/A mol |