0.2mol有机物A和0.4mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。燃烧后的这些产物经过浓硫酸后,质量增加10.8g;再通过灼热的CuO充分反应后,固体质量减轻3.2g;最后气体再通过碱石灰被完全吸收,质量增加17.6g。
(1)推断该有机物A的分子式。
(2)若0.2mol该有机物A与过量金属钠反应后放出4.48L H2(标准状况下),试确定该有机物的结构简式。
用石墨电极电解100 mLH2SO4和CuSO4的混合液,通电一段时间,两极上均产生2.24L(标准状况)气体,则原混合液中Cu2+的浓度是多少?
有一个十肽A,其分子式为C65H86O17N12,A完全水解可以得到以下4种氨基酸:
试通过计算(或推理)确定四种氨基酸的个数。
四种氨基酸按题给顺序分别是1、2、3、4个。
40mL 2mol/L的NaOH 溶液和40mL 2mol/L 的盐酸在19℃时混合,混合后测得溶液的温度为32.6℃。求反应的中和热[混合后溶液的比热容c ="" 4.18 J/(g·℃)]。
40mL 2mol/L的NaOH 溶液和40mL 2mol/L 的盐酸在19℃时混合,混合后测得溶液的温度为32.6℃。求反应的中和热[混合后溶液的比热容c ="" 4.18 J/(g·℃)]。
向含有0.8mol的稀硝酸溶液中慢慢加入22.4g的铁粉.假设反应分为两个阶段.第一阶段为:Fe+HNO3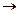 Fe(NO3)3+NO↑+H2O
Fe(NO3)3+NO↑+H2O (1)写出这两个阶段反应的离子方程式.
(1)写出这两个阶段反应的离子方程式. (2)求这两个阶段反应中,加入铁粉的物质的量和溶液中铁元素存在的形式.
(2)求这两个阶段反应中,加入铁粉的物质的量和溶液中铁元素存在的形式. (3)在图中画出溶液中Fe2+、
(3)在图中画出溶液中Fe2+、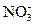 离子的物质的量随加入铁粉的物质的量变化的关系图像(纵坐标是溶液中离子的物质的量).
离子的物质的量随加入铁粉的物质的量变化的关系图像(纵坐标是溶液中离子的物质的量).