(4分)下列叙述正确的是________________(选对一个给2分,多选、错选一个扣1分,本题不出现负分)。
| A.不慎把苯酚溶液沾到了皮肤上,应立即用大量水冲洗。 |
| B.甲、乙两种有机物具有相同的相对分子质量和不同结构,则甲和乙一定是同分异构体。 |
| C.浓溴水滴入苯酚溶液中立即产生2,4,6-三溴苯酚的白色沉淀。 |
| D.溴的苯溶液中加少量铁粉后会剧烈反应,并放出大量的热,但该现象不能说明苯和溴的取代反应就是放热反应。 |
E.分离沸点相差30℃以上的混溶液体,应采用的方法是分馏
F.实验室使用体积比为1:3的浓硫酸与乙醇的混合溶液制乙烯时,为防加热时反应混合液出现暴沸现象,除了要加沸石外,还应注意缓慢加热让温度慢慢升至170℃。
G.除去混在苯中的少量苯酚,加入过量溴水,过滤。
化合物A(C8H8O3)为无色液体,难溶于水,有特殊香味,从A出发,可发生图示的一系列反应,图中的化合物A苯环上取代时可生成两种一取代物,化合物D能使FeCl3溶液显紫色,G能进行银镜反应。E和H常温下为气体。试回答:
(1) 写出下列化合物的结构简式:
A:;B:;E:G:
(2)反应类型:( I );(Ⅱ)。
(3) 写出D→H的化学方程式:。
(4) D的一种同分异构体可制备药物阿司匹林(乙酰水杨酸),请写出有关反应方程式。
铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
①该反应的平衡常数表达式为:K=。
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为。
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
①②。
(3)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)
和温度(T)的关系示意图中与铝热反应最接近的是。
(4)写出氢氧化铝在水中发生酸式电离的电离方程式:,欲使上述体系中Al3+浓度增加,可加入的物质是。
为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。请填空: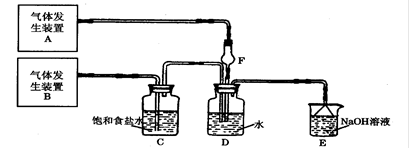
(1)D装置中主要反应的离子方程式为,F仪器的作用是。
(2)为验证通入D装置中的气体是Cl2还是SO2过量,兴趣小组的同学准备了以下试剂:
a 氯化铁稀溶液 b 氯化亚铁溶液 c 硫氰化钾溶液
d 苯酚溶液 e 品红溶液 f 酸性高锰酸钾溶液
①若Cl2过量:取适量D中溶液滴加至盛有(选填一个符号)试剂的试管内,再加入(选填一个符号)试剂,发生的现象是:;
②若选用上述试剂中的一种再结合必要的操作就可以验证通入D装置中的气体是Cl2过量还是SO2过量,该试剂是(选填一个符号)。必要的操作和结论是。
在元素周期表中,相邻近的元素在结构和性质上有许多相似之处。
(1)第二周期的碳、氮、氧、氟都可以形成氢化物,氧元素的氢化物除H2O外,还有H2O2;碳元素的氢化物除CH4外,还有C2H6等;与之相似的氮元素的氢化物除NH3外,还有________(填化学式),其沸点比液氨____(填“高”或“低”),该氢化物与足量盐酸反应的化学方程式为______________________________。
(2)氮原子间也可形成链状结构,假设氮原子间只以N-N键形式连接,并形成氢化物,则该系列氢化物的通式为___________________。
(3) (2)题的通式中氮原子数是2的化合物和NO2混合发生反应生成N2和H2O(气),今知4 g该气态化合物在上述反应中放出71kJ热量,写出其热化学方程式为:
。由于该反应放出大量热,可作火箭推进剂,发射宇宙飞船。载人飞船内需要有一种化合物来吸收宇航员呼出的 CO2并提供O2,写出该物质的电子式________________。飞船中需要制造一种适合宇航员生存的人工生态环境,应该在氧气中充入一种气体用于稀释氧气,该气体分子的电子式是__________。
下图是常用的实验仪器:(铁架台和玻璃导管、橡皮管、瓶塞等略去)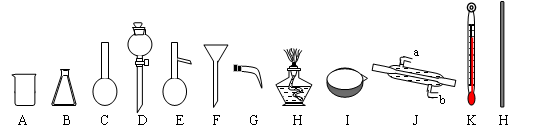
用仪器对应的英文字母及相关文字填空:
(1)填写以下仪器的名称:BDEI
(2)用四氯化碳提取出溴水中Br2单质的方法叫做:。能否用酒精代替四氯化碳进行
实验?原因是:
(3)将Br2的四氯化碳溶液和水分离开的操作叫做:。下列是进行该操作的步骤,正确的
顺序是:
① 将混合物倒入分液漏斗中,并放在铁架台的铁圈上静置、分层;
② 从分液漏斗上口倒出上层水溶液;
③ 将分液漏斗的玻璃塞打开或使玻璃塞上的凹槽对准漏斗颈部的小孔
④ 分液漏斗下面导管紧贴烧杯内壁,旋开活塞,用烧杯接受溶液
⑤ 检查分液漏斗活塞和颈部的玻璃塞是否漏水
(4)已知Br2的沸点是58.5℃,四氯化碳沸点是78℃。将Br2的四氯化碳溶液分离开的方法是,
需要用到的仪器有。连接装置时,仪器J的冷凝水应该进出(填a、b)。