已知下列几个反应的化学方程式:
① 2H2S + SO2 =" 3S↓+" 2H2O
② 2KI + Cl2 =" 2KCl" + I2
③ 2FeCl2 + Cl2 = 2FeCl3
④ 2FeCl3 + 2HI =2FeCl2 + I2 + 2HCl
⑤ I2 + SO2 + 2H2O = H2SO4+ 2HI
下列有关物质的氧化性的强弱排列顺序中正确的是
| A.Cl2>Fe3+>I2>SO2 | B.Cl2 >I2>Fe3+>SO2 |
| C.Cl2>Fe3+>SO2>I2 | D.Fe3+>I2>Cl2 >SO2 |
下列说法正确的是
| A.硫酸、纯碱、硝酸钠和生石灰分别属于酸、碱、盐和氧化物 |
| B.根据元素种类的多少将物质分为纯净物和混合物 |
| C.通常情况下,若发生反应A2 + 2B-= 2A-+ B2,则氧化剂是A2 |
| D.碳酸氢钠在水中的电离方程式:NaHCO3=Na++H++CO32- |
下列反应的离子方程式正确的是
| A.金属镁与稀盐酸反应 :Mg+2H++2Cl-===MgCl2+H2↑ |
B.氯化钡溶液与硫酸反应 :Ba2++ SO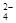 ===BaSO4↓ ===BaSO4↓ |
| C.碳酸钠溶液与盐酸反应 :Na2CO3+2H+===2Na++H2O+CO2↑ |
| D.氢氧化镁与硫酸溶液反应:OH-+H+===H2O |
影响一定数量气体体积大小的主要因素是
| A.气体分子的摩尔质量 | B.微粒本身的大小 |
| C.微粒的质量 | D.微粒间的平均距离 |
已知3.01×1023个X气体分子的质量为16 g,则X气体的摩尔质量是
| A.16 g | B.32 g | C.64 g /mol | D.32 g /mol |
配制一定体积、一定物质的量浓度的溶液时,下列操作会使配得的溶液浓度偏小的是
| A.容量瓶中原有少量蒸馏水 |
| B.溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
| C.定容时观察液面俯视 |
| D.滴管加水时,有少量水滴到容量瓶外 |