【化学—选修2:化学与技术】 请回答氯碱工业的如下问题:
请回答氯碱工业的如下问题: (1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果); (2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号) (3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。 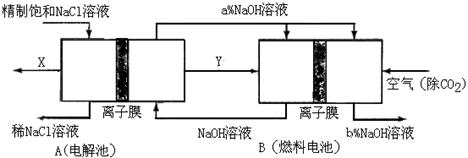
 ①图中X是__ ___(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
①图中X是__ ___(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________; ②分别写出燃料电池B中正极、负极上发生的电极反应正极:______; 负极:_____;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______; 负极:_____; ③这样设计的主要节(电)能之处在于(写出2处)____________、____________。
③这样设计的主要节(电)能之处在于(写出2处)____________、____________。
(16分)用芒硝(Na2SO4·10H2O)制备纯碱、铵明矾[NH4Al(SO4)2·12H2O]的生产工艺流程图如下所示:
(1)溶液C中的溶质主要是 。
(2)铵明矾的溶液呈 性,铵明矾可用于净水,用离子方程式说明原理 。
(3)过程Ⅰ反应温度不能超过40℃,主要原因是 。
(4)运用化学平衡原理解释Na2SO4溶液稍过量的原因
(5)滤液E中溶质离子为
(6)写出工艺流程中焙烧的反应方程式
工业上从电解精炼铜的阳极泥(含金、银、铜、硒等单质)中提取硒的湿法工艺流程如下: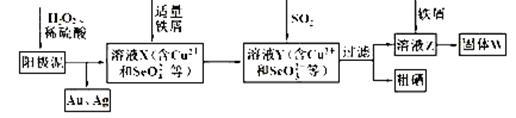
(1)向溶液X中加入铁屑的作用是______ ,此操作中不能加入过量铁粉的原因是______。
(2)检验溶液Z中阴离子的操作方法是______。
(3)过滤操作中要用到玻璃棒,请另举两例用到玻璃棒的实验或操作:______。
(4)实验室中制取SO2的原理为: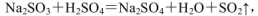 ,此处应使用______(填“较浓的硫酸”或“稀硫酸”),原因是______。制取SO2的装置,最好选用下图中的______。
,此处应使用______(填“较浓的硫酸”或“稀硫酸”),原因是______。制取SO2的装置,最好选用下图中的______。
(5)粗硒中硒的含量可用如下方法测定: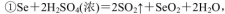
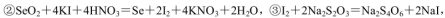 通过用Na2S2O3标准溶液(显碱性)滴定反应②中生成的I2来计算硒的含量。滴定操作中用到的玻璃仪器有_______。实验中准确称量0.1200g粗硒样品,滴定中消耗0.2000mol
通过用Na2S2O3标准溶液(显碱性)滴定反应②中生成的I2来计算硒的含量。滴定操作中用到的玻璃仪器有_______。实验中准确称量0.1200g粗硒样品,滴定中消耗0.2000mol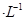 的Na2S2O3溶液27.60mL,则粗硒样品中硒的质量分数为 。
的Na2S2O3溶液27.60mL,则粗硒样品中硒的质量分数为 。
【改编】(18分)NOx、SO2是主要的大气污染物,科学处理这些污染物对改善人们的生存环境具有重要的现实意义。
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ•mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ•mol-1
则CH4与NO反应生成N2与CO2的热化学方程式为:______________________________________。
(2)利用氧化氮氧化物的流程如下:
写出反应Ⅱ的化学方程式 ___________________;已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应Ⅱ中生成N2的体积(标准状况下)为2.24L,则反应I中转移电子的物质的量为_________,还原剂的质量为_________。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水电离出的OH‾浓度_________(填“增大”、“减小”或“不变”);试计算溶液中  。
。
(常温下H2SO3的电离常数: )
)
(4)利用Fe2(SO4)3溶液也可处理SO2废气,其流程如下图所示。
①简述用Fe2(SO4)3晶体配制溶液A的方法__________________。
②写出向溶液A中通入含SO2废气反应的离子方程式______________________________。
③设计实验验证溶液B是否仍具有处理废气的能力,简述实验的操作、现象和结论_______________。
(17分)金属镍具有优良的物理和化学特性,是高技术产业的重要原料。
(1)羰基法提纯镍涉及的反应为:Ni(s)+4CO(g) Ni(CO)4(g)
Ni(CO)4(g)
①当温度升高时, 减小,则H 0(填“>”或“<”)。
减小,则H 0(填“>”或“<”)。
②一定温度下,将一定量的粗镍和CO加入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________(填代号)。
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数 (填“增大”、“不变”或“减小”),反应进行3s后测得Ni(CO)4的物质的量为0.6mol,则0—3s内的平均反应速率v(CO)=____mol 。
。
③要提高上述反应中CO的转化率,同时增大反应速率,可采取的措施为____________________(写出一条措施即可)。
(2)以NiS04溶液为电解质溶液进行粗镍(含Fe、Zn、Cu、Pt、Au等杂质)的电解精炼,下列说法正确的是____________(填代号)。(已知氧化性: )
)
a.电解过程中,化学能转化为电能
b.粗镍作阳极,发生还原反应
c.利用阳极泥可回收Cu、Pt、Au等金属
d.粗镍精炼时通过的电量与阴极析出镍的质量成正比
(3)工业上用硫化镍(NiS)作为电极材料冶炼镍。电解时,硫化镍中的硫元素以单质形态沉积在某电极附近,镍元素以Ni2+形态进入电解液中,如图所示。硫化镍与电源的____________(填“正极”或“负极”)相接。写出阳极的电极反应式________________。
(1)已知:C(s)+O2(g)=CO2(g)ΔH1=-393.5 kJ/mol
C(s)+H2O(g)=CO(g)+H2(g)ΔH2=+131.3 kJ/mol
则反应CO(g)+H2(g) +O2(g)=H2O(g)+CO2(g),ΔH=____ ___kJ/mol。
(2)在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g) CH3OH(g)ΔH
CH3OH(g)ΔH
①下列情形不能说明该反应已达到平衡状态的是_______(填序号)。
A.每消耗1 mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②CO的平衡转化率(α)与温度、压强的关系如图所示。A、B两点的平衡常数K(A)_______K(B)(填“>”、“=”或“<”,下同);由图判断ΔH _____0。
③某温度下,将2.0 mol CO和6.0 molH2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.25mol/L,则CO的转化率= ,此温度下的平衡常数K= (保留二位有效数字)。
(3)工作温度650℃的熔融盐燃料电池,用煤炭气(CO、H2)作负极反应物,空气与CO2的混合气体为正极反应物,催化剂镍作电极,用一定比例的Li2CO3和Na2CO3低熔点混合物作电解质。负极的电极反应式为:CO+H2-4e-+2CO32-=3CO2+H2O;则该电池的正极反应式为 。