(17分)金属镍具有优良的物理和化学特性,是高技术产业的重要原料。
(1)羰基法提纯镍涉及的反应为:Ni(s)+4CO(g) Ni(CO)4(g)
Ni(CO)4(g)
①当温度升高时, 减小,则H 0(填“>”或“<”)。
减小,则H 0(填“>”或“<”)。
②一定温度下,将一定量的粗镍和CO加入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________(填代号)。

若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数 (填“增大”、“不变”或“减小”),反应进行3s后测得Ni(CO)4的物质的量为0.6mol,则0—3s内的平均反应速率v(CO)=____mol 。
。
③要提高上述反应中CO的转化率,同时增大反应速率,可采取的措施为____________________(写出一条措施即可)。
(2)以NiS04溶液为电解质溶液进行粗镍(含Fe、Zn、Cu、Pt、Au等杂质)的电解精炼,下列说法正确的是____________(填代号)。(已知氧化性: )
)
a.电解过程中,化学能转化为电能
b.粗镍作阳极,发生还原反应
c.利用阳极泥可回收Cu、Pt、Au等金属
d.粗镍精炼时通过的电量与阴极析出镍的质量成正比
(3)工业上用硫化镍(NiS)作为电极材料冶炼镍。电解时,硫化镍中的硫元素以单质形态沉积在某电极附近,镍元素以Ni2+形态进入电解液中,如图所示。硫化镍与电源的____________(填“正极”或“负极”)相接。写出阳极的电极反应式________________。

工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号)__________
| A.生成CH3OH的速率与消耗CO的速率相等 | B.混合气体的密度不变 |
| C.混合气体的相对平均分子质量不变 | D.CH3OH、CO、H2的浓度都不再发生变化 |
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
①该反应化学平衡常数表达式K=
②由表中数据判断该反应的△H__________0(填“>”、“=”或“<”);
③某温度下,将2molCO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得C(CO)=0.2mol·L-1,此时的温度为__________
(3)25℃101KPa下,1g液态甲醇完全燃烧生成CO2和液态水时放出热量22.68kJ,表示甲醇燃烧热的热化学方程式为
(4)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,该电池工作时负极电极反应式为。若反应时消耗16g甲醇所产生的电能电解足量的CuSO4溶液,则将产生标准状况下的O2________升
尿素可作为H2O2的稳定载体,生产一种固态、耐储存、易运输的新型氧化剂和消毒剂—过氧化尿素[CO(NH2)2·H2O2],其合成工艺流程如下: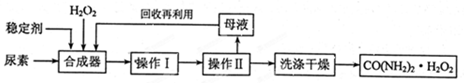
请回答下列问题:
(1)操作I、II的名称分别是______、_______。CO(NH2)2·H2O2分子中尿素和过氧化氢之间以________结合,其结合力较弱,具有尿素和过氧化氢双重性质。
(2)工业上生产尿素所需的原料气可由天然气与水反应制备,已知:
①甲烷、氢气的燃烧热分别为890.3KJ/mol、285.8kJ/mol
②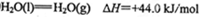
写出CH4与水蒸气作用生产CO2和H2的热化学方程式:_______________。
(3)合成过氧化氢尿素加入的稳定剂可以是水杨酸、酒石酸等。酒石酸分子式为C4H6O6,其核磁共振氢谱只有3种锋,只含羧基和羟基两种官能团,则酒石酸的结构简式为_____。
(4)为测定产品中H2O2的含量,称取干燥样品12.0g配成250mL溶液,取25.00mL
于锥形瓶中,加入适量硫酸酸化,用0.20mol/LKMnO4标准溶液滴定,三次滴定平均消耗KMnO4溶液20.00mL.(KMO4溶液与尿素不反应).
①完成并配平方程式: MnO4-+
MnO4-+  H2O2+
H2O2+  _________=Mn2++
_________=Mn2++ O2↑+
O2↑+ ___;
___;
②计算出产品中H2O2的质量分数为_______。
(5)电解尿素的废水既可以处理废水,又可制得纯氢,电解原理如图所示。电解池中隔膜仅阻止气体通过,B两极均为惰性电极。B极连接电源的____极(填
“正”或“负”),阳极电极反应方程为_____________。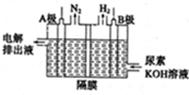
W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,几种物质的转化关系如图I所示。常温下0.01mol/L-1丙溶液
PH=12;XY2分子是非极性分子,但科学家在特殊条件下制得了XY2的原子晶体,其晶胞结构如图II所示。请回答下列问题: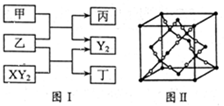
(1)甲与乙反应的化学方程式是______。
(2)甲的中心原子杂化轨道类型为_____;
XY2分子中, 键与π键的数目之比为_________;
键与π键的数目之比为_________;
XY2原子晶体的1个晶胞中含有_______个原子。
W、X、Y、Z四种元素电负性由大到小的顺序是_______(用元素符号表示)。
工业上用氯气与潮湿的丁反应制备次氯酸的酸酐(棕黄色气体),同时生成小苏打和食盐混合物,反应的化学方程式是______________________________。
元素周期表是学习化学的重要工具,它隐含着许多信息和规律,下面是八种短周期元素的相关信息(已知铍的原子半径为0.089nm)
| 元素代号 |
A |
B |
C |
D |
E |
| 原子半径/nm |
0.16 |
0.143 |
0.102 |
0.099 |
0.074 |
| 主要化合价 |
+2 |
+3 |
+6,-2 |
-1 |
-2 |
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色(用相应的元素符号完成下列空白)
(1)B元素在元素周期表中的位置___________________,上述八种元素的最高价氧化物对应的水化物中酸性最强的是__________,A离子的结构示意图_______________。
(2)用电子式表示A、D形成化合物的过程:____________________________________。H、E形成原子个数比为1:1的化合物的电子式为___________,含有的化学键类型为____________。C2D2的电子式为______________________。
(3)下列说法能说明D的非金属性比C强的选项____________
①H2CO4比HDO稳定②HDO4比H2CO4酸性强③C2-比D-易被氧化④HD比H2C稳定⑤铜与HD不反应,但能与浓H2CO4反应⑥铁与D2加热生成FeD3,铁与C加热生成FeC⑦C原子与D原子电子层数相同,D原子半径小于C原子。
A、全部 B、②③④⑥⑦ C、①②④⑤⑥ D、除①以外
(4)A、B、C、D、E形成的简单离子半径由大到小的顺序为_______________________。(用具体离子符号表示)
(5)C单质与H的最高价氧化物对应水化物在加热条件下能发生反应,若有3mol的C参与反应,转移4NA的电子,请写出离子反应方程_______________________________________,氧化剂与还原剂的质量之比_____________________。
(13分)有短周期元素A、B、C、D、E、F六种短周期元素,其原子序数依次增大。其中A是周期表中原子半径最小的元素,B的核外有两个电子层,其核外电子数为两层电子数之差的三倍;A、E和D、F分别同族。D的最外层电子数等于B的原子序数。试根据以上叙述回答:
(1)写出元素符号:C____________、D____________、E_____________、F_____________;
(2)写出由A、D、E、F四种元素组成的两种盐反应的离子方程式________________________;
(3)E单质点燃时生成的淡黄色固态化合物与水反应的化学方程式:______;
(4)A与C的最低价形成的化合物为M:
① 设计简单实验验证M的浓溶液的酸碱性________________________。(写出操作、现象和结论)
②写出M催化氧化的化学方程式_________________。