尿素可作为H2O2的稳定载体,生产一种固态、耐储存、易运输的新型氧化剂和消毒剂—过氧化尿素[CO(NH2)2·H2O2],其合成工艺流程如下: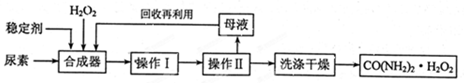
请回答下列问题:
(1)操作I、II的名称分别是______、_______。CO(NH2)2·H2O2分子中尿素和过氧化氢之间以________结合,其结合力较弱,具有尿素和过氧化氢双重性质。
(2)工业上生产尿素所需的原料气可由天然气与水反应制备,已知:
①甲烷、氢气的燃烧热分别为890.3KJ/mol、285.8kJ/mol
②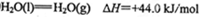
写出CH4与水蒸气作用生产CO2和H2的热化学方程式:_______________。
(3)合成过氧化氢尿素加入的稳定剂可以是水杨酸、酒石酸等。酒石酸分子式为C4H6O6,其核磁共振氢谱只有3种锋,只含羧基和羟基两种官能团,则酒石酸的结构简式为_____。
(4)为测定产品中H2O2的含量,称取干燥样品12.0g配成250mL溶液,取25.00mL
于锥形瓶中,加入适量硫酸酸化,用0.20mol/LKMnO4标准溶液滴定,三次滴定平均消耗KMnO4溶液20.00mL.(KMO4溶液与尿素不反应).
①完成并配平方程式: MnO4-+
MnO4-+  H2O2+
H2O2+  _________=Mn2++
_________=Mn2++ O2↑+
O2↑+ ___;
___;
②计算出产品中H2O2的质量分数为_______。
(5)电解尿素的废水既可以处理废水,又可制得纯氢,电解原理如图所示。电解池中隔膜仅阻止气体通过,B两极均为惰性电极。B极连接电源的____极(填
“正”或“负”),阳极电极反应方程为_____________。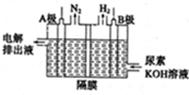
【化学一选修2:化学与技术】(15分)三氧化二镍(Ni2O3)是一种重要的蓄电池材料。工业上利用镍废料(镍、铁、钙、镁合金为主)制取草酸镍晶体(NiC2O4-2H2O),再高温煅烧草酸镍晶体制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。下列工艺流程示意图如下;
回答下列问题
(1)为提高酸溶操作中镍废料的转化率,可采取的措施有答出三条。
(2)加入H2O2发生的主要反应的离子方程式为。
(3)加入NH4F后除掉的杂质是____
(5)工业上还可用电解法制取Ni2O3。用NaOH溶液调节NiCl2溶液的pH至7.5,加入适量Na2S04后采用惰性电极电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO—,再把二价镍氧化为三价镍。当amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为____。电解法制取Ni203的实际过程中,先获得一种结晶水合物,己知含1 mol Ni的诙结晶水合物中含有0.5 mol结晶水。取该化合物20.2 g进行充分加热,获得Ni203固体和0.2 mol水,则该结晶水合物的化学式为.
【化学——选修2:化学与技术】(15分)2014中国(海南)国际海洋产业博览会于2014年10月17日至19日在海南国际会展中心举办。海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)工业上从海水中提取的NaCl可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,,后通入气体B,充分反应后得到晶体NaHCO3,再将其灼烧得到纯碱,气体A、B是CO2或NH3,则气体A应是(填化学式),原因是。
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。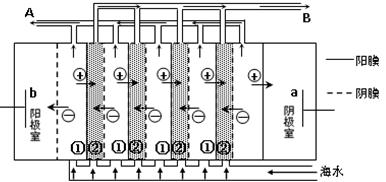
其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题:
①海水不能直接通入到阴极室中,理由是。
②A口排出的是(填“淡水”或“浓水”)。
(3)用苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下:
①若吸收塔中的溶液含BrO3-,则吸收塔中反应的离子方程式为。
②通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液。
③向蒸馏塔中通入水蒸气加热,控制温度在90 ℃左右进行蒸馏的原因是。
(12分)Mn(OH)2常用作油漆催干剂。向MnSO4溶液加入NaOH溶液,待沉淀完全后,过滤,洗涤,烘干即可制得Mn(OH)2。
(1)已知:常温下Mn(OH)2的Ksp=1.0×10-15。如果要使溶液中Mn2+沉淀完全,则应该保持溶液中c(OH—)≥mol·L—1[当c(Mn2+)≤10-5mol/L时,即可认为溶液中Mn2+沉淀完全]。
(2)Mn(OH)2还可以通过MnO2与二氧化硫气体充分接触,再与石灰乳反应制得,写出该反应的总的化学方程式。
(3)一种含Mn2+的结晶水合物组成为AxMnyBz·mH2O(A表示一种阳离子,B表示一种阴离子)。现称取39.10 g晶体配成100 mL溶液X,取20 mL溶液X,向其中加入足量的氢氧化钠溶液,加热,得到896 mL气体(标准状况);另取20 mL溶液X,向其中加入盐酸,无沉淀产生,再加入BaCl2溶液,产生白色沉淀,过滤,洗涤,烘干,得到固体9.32 g。
①A、B的离子符号分别为、。
②通过计算确定该结晶水合物的化学式(写出计算过程)。
铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水。
(1)还原沉淀法是处理含Cr2O72—和CrO42—工业废水的一种常用方法,其工艺流程为:
其中第I步存在平衡:2CrO42—(黄色)+2H+ Cr2O72— (橙色)+H2O
Cr2O72— (橙色)+H2O
①若平衡体系的pH=2,该溶液显色。
②根据2CrO42—+2H+ Cr2O72— +H2O,设计下图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。Na2Cr2O7中铬元素的化合价为,图中右侧电极连接电源的极,其电极反应式为。
Cr2O72— +H2O,设计下图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。Na2Cr2O7中铬元素的化合价为,图中右侧电极连接电源的极,其电极反应式为。
③第Ⅱ步反应的离子方程式:,向Ⅱ反应后的溶液加一定量NaOH,若溶液中c(Fe3+)=2.0×10—12mol·L—1,则溶液中c(Cr3+)=mol·L—1。(已知Ksp[Fe(OH)3]=4.0×10—38,Ksp[Cr(OH)3]=6.0x10—31)。
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。完成该反应的化学方程式:
(3)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。B点时剩余固体的成分是(填化学式)。
【化学——选修2:化学与技术】(15分)煤是一种重要的化石能源。请回答:
(1)煤的加工包括干馏、_________和液化,煤的液化技术又分为_________和_________。
(2)干熄焦技术是将炼焦炉推出的约l000 的赤热焦炭,在熄焦室中被与其逆流的冷惰性气体熄灭,逆流通人惰性气体的原因是_________。
的赤热焦炭,在熄焦室中被与其逆流的冷惰性气体熄灭,逆流通人惰性气体的原因是_________。
(3)某工厂每天要烧掉含硫1.6%的烟煤200吨,排放出大量的SO2,如果将这些SO2回收利用,那么理论上每年(按365天计)可生产98%的浓硫酸_________吨。
(4)石膏法脱硫是烟气脱硫技术中最成熟的一种方法,工艺如图,吸收、氧化过程的化学方程式为____。实际生产时采用石灰石浆液作SO2吸 收剂而不用熟石灰吸收SO2,主要原因是_________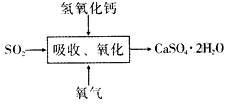
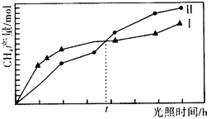
(5)煤燃烧产生的CO2在光能和光催化剂存在的条件下可与H2O(g)转化为CH4和O2,反应的化学方程式为_________。紫外光照射时,等量的CO2和H2O(g)在不同催化剂(I、Ⅱ)作用下,CH4产量随光照时间的变化如图所示,光照t小时后催化剂Ⅱ作用下CH4的产量开始高于催化剂I,其原因可能是_________