【化学——选修2:化学与技术】(15分)2014中国(海南)国际海洋产业博览会于2014年10月17日至19日在海南国际会展中心举办。海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)工业上从海水中提取的NaCl可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,,后通入气体B,充分反应后得到晶体NaHCO3,再将其灼烧得到纯碱,气体A、B是CO2或NH3,则气体A应是 (填化学式),原因是 。
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。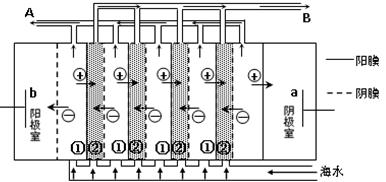
其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题:
①海水不能直接通入到阴极室中,理由是 。
②A口排出的是 (填“淡水”或“浓水”)。
(3)用苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下:
①若吸收塔中的溶液含BrO3- ,则吸收塔中反应的离子方程式为 。
②通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液 。
③向蒸馏塔中通入水蒸气加热,控制温度在90 ℃左右进行蒸馏的原因是 。
某含氧衍生物可以作为无铅汽油的抗爆剂,它的相对分子质量为88.0,含C的质量分数为68.2%,含H的质量分数为13.6%,红外光谱和核磁共振氢谱显示该分子中有4个甲基。请写出其结构简式。(要有解题过程)
依据事实,写出下列反应的热化学方程式。
(1)1molC2H4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出1411kJ热量。
(2)1molC2H5OH(l)与适量O2(g)反应生成CO2(g)和H2O(l),放出1366.8kJ热量。
(3)2molAl(s)与适量O2(g)反应生成Al2O3(s),放出1669.8kJ热量。
某含氧有机化合物可以作为无铅汽油的抗暴剂。它的蒸气密度是同温同压下CO2的2倍,含碳的质量分数为68.2%,含氢的质量分数为13.6%,红外光谱和核磁共振显示该分子有4个甲基,通过计算推导出分子式和结构简式。
已知下列热化学方程式:
①C(s)+O2(g)=CO2(g)△H1 =-393.5 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g)△H2 =-566.0 kJ·mol-1
③2H2(g)+O2(g)=2H2O(l)△H3 =-571.6 kJ·mol-1
通过计算(要有计算过程),写出1 mol C与液态H2O反应生成CO和H2的热化学方程式。
C、N、O是中学化学常见的三种元素,请回答下列问题:
(1)写出基态O2-的核外电子排布式______________________________。
(2)C、N、O三种元素的第一电离能由大到小的顺序为_____________________________。
(3)光气(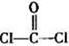 )分子中含有______个
)分子中含有______个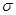 键,____个
键,____个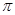 键,其中C原子的杂化方式为_______。
键,其中C原子的杂化方式为_______。
(4)水的熔点比H2S的熔点高,其原因是________________。
(5)超硬材料氮化销的晶胞如图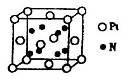 所示,则氮化铂的化学式为_______。
所示,则氮化铂的化学式为_______。