依据事实,写出下列反应的热化学方程式。
(1)1molC2H4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出1411kJ热量。
(2)1molC2H5OH(l)与适量O2(g)反应生成CO2(g)和H2O(l),放出1366.8kJ热量。
(3)2molAl(s)与适量O2(g)反应生成Al2O3(s),放出1669.8kJ热量。
(1)I.短周期某主族元素M的电离能情况如右图(A)所示。则M元素位于周期表的第族。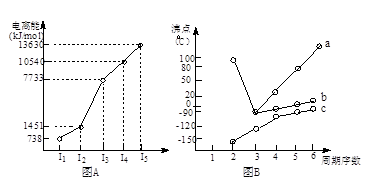
II.图B折线c可以表达出第族元素氢化物的沸点的变化规律。两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:__________(填“a”或“b”)
III.部分有机物的熔沸点见下表:
| 烃 |
CH4 |
CH3CH3 |
CH3(CH2)2CH3 |
硝基苯酚 |
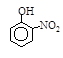 |
 |
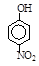 |
| 沸点/℃ |
-164 |
-88.6 |
-0.5 |
熔点/℃ |
45 |
96 |
114 |
根据物质结构理论,由这些数据你能得出的相关结论是(至少写2条):
,
。
(2)COCl2俗称光气,分子中C原子采取杂化成键;其中碳氧原子之间共价键含有
________(填字母):
a.2个σ键;b.2个π键;c.1个σ键.1个π键。
(3)金属是钛(22Ti) 将是继铜.铁.铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布式为;
II.已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种晶体的样品配成溶液;b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现产生的沉淀质量关系为:绿色晶体为紫色晶体的2/3。则绿色晶体配合物的化学式为。
(16分) 氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300-1700oC的氮气流中反应制得3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)上述反应氧化剂是,已知该反应每转移1mole—,放出132.6kJ的热量,该方程式的∆H =。
(2)能判断该反应(在体积不变的密闭容器中进行)已经达到平衡状态的是()
A.焦炭的质量不再变化 B.N2和CO速率之比为1:3
C.生成6molCO同时消耗1mol Si3N4 D.混合气体的密度不再变化
(3)下列措施中可以促进平衡右移的是()
A.升高温度 B.降低压强 C.加入更多的SiO2 D.充入N2
(4)该反应的温度控制在1300-1700oC的原因是。
(5)某温度下,测得该反应中N2和CO各个时刻的浓度如下,求0—20 min内N2的平均反应速率,该温度下,反应的平衡常数K=。
| 时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
| N2浓度/mol·L-1 |
4.00 |
3.70 |
3.50 |
3.36 |
3.26 |
3.18 |
3.10 |
3.00 |
3.00 |
3.00 |
| CO浓度/mol·L-1 |
0.00 |
0.90 |
1.50 |
1.92 |
2.22 |
2.46 |
2.70 |
工业上需要利用一批回收的含铜废料制造胆矾(CuSO4·5H2O)。该废料中各种成份含量如下:Cu和CuO约占87%,其它为Mg、Al、Fe、Si及其氧化物,还有少量的难溶物质。工艺流程为:

部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH如下表:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Cu(OH)2 |
Mg(OH)2 |
Fe(OH)2 |
| pH |
5.2 |
3.1 |
6.7 |
9.4 |
9.7 |
回答:
(1)步骤①中为什么要将含铜废料研磨成粉状?
。
(2)步骤②中的离子方程式(写出2个即可):
、。
步骤⑤中H2O2参加反应的离子方程式:。
(3)步骤⑥中调节溶液pH时适宜的物质是(填序号);
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Cu(OH)2 E.MgCO3
步骤⑥中滤渣成份的化学式。
(4)步骤⑦中用硫酸调节pH=2~3的原因是。
步骤⑧的分离方法是。
Fe3P与稀HNO3反应生成Fe(NO3)3、NO、H3PO4和H2O。
(1) 写出反应的化学方程式:_______________________________________;
(2) 上述反应中,当生成1.8 mol Fe3+时,放出NO的体积(标准状况下)是__________L,消耗的HNO3是__________mol;
(3) 上述反应中,当有21 mol电子发生转移时,生成H3PO4是_________mol,被还原的HNO3是___________g。
在含n mol FeBr2的溶液中,通入Cl2,有x mol Cl2发生反应。
(已知:还原性:Fe2+>Br—)
(1)当x≤ 时,反应的离子方程式为:。
时,反应的离子方程式为:。
(2)当反应的离子方程式为:2Fe2++4Br -+3Cl2=2Fe3++2Br2+6Cl-时,x与n的关系为。