C、N、O是中学化学常见的三种元素,请回答下列问题:
(1)写出基态O2-的核外电子排布式______________________________。
(2)C、N、O三种元素的第一电离能由大到小的顺序为_____________________________。
(3)光气(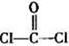 )分子中含有______个
)分子中含有______个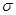 键,____个
键,____个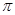 键,其中C原子的杂化方式为_______。
键,其中C原子的杂化方式为_______。
(4)水的熔点比H2S的熔点高,其原因是________________。
(5)超硬材料氮化销的晶胞如图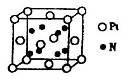 所示,则氮化铂的化学式为_______。
所示,则氮化铂的化学式为_______。
研究
在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的
主要以4种无机碳形式存在,其中
占95%,写出
溶于水产生
的方程式:。
(2)在海洋循环中,通过下图所示的途径固碳。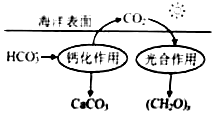
①写出钙化作用的离子方程式:。
②同位素示踪法证实光合作用释放出的
只来自于
,用
标记物质的光合作用的化学方程式如下,将其补充完整:+=
+
+
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:
①气提、吸收
,用
从酸化后的还说中吹出
并用碱液吸收(装置示意图如下),将虚线框中的装置补充完整并标出所用试剂。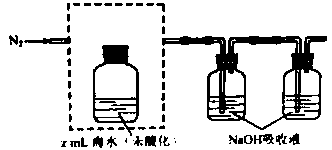
②滴定。将吸收液洗后的无机碳转化为
,再用
溶液滴定,消耗
溶液,海水中溶解无机碳的浓度=
。
(4)利用下图所示装置从海水中提取
,有利于减少环境温室气体含量。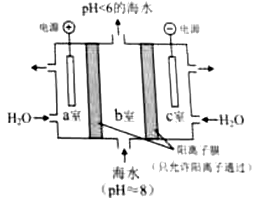
①结合方程式简述提取
的原理:。
②用该装置产生的物质处理
室排出的海水,合格后排回大海。处理至合格的方法是。
氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
(1)反应Ⅰ的化学方程式是。
(2)反应Ⅰ得到的产物用
进行分离。该产物的溶液在过量
的存在下会分成两层--含低浓度
的
层和高浓度的
的
层。
①根据上述事实,下列说法正确的是(选填序号)。
a.两层溶液的密度存在差异
b.加
前,
溶液和HI溶液不互溶
c.
在
溶液中比在
溶液中易溶
②辨别两层溶液的方法是。
③经检测,
层中
=2.06:1。其比值大于2的原因是。
(3)反应Ⅱ:
它由两步反应组成:i.
ii.
分解。
L(L1、L2),X可分别代表压强或温度。下图表示L一定时,ii中
的平衡转化率随X的变化关系。
①X代表的物理量是。
②判断L1、L2的大小关系,并简述理由:。
硼氢化钠(
)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备
,其流程如下:
已知:
常温下能与水反应,可溶于异丙酸(沸点:13℃)。
(1)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是,原料中的金属钠通常保存在中,实验室取用少量金属钠需要用到的实验用品有,,玻璃片和小刀等。
(2)请配平第①步反应的化学方程式:
+□
+□
+□
==□
+□
(3)第②步分离采用的方法是;第③步分离(
)并回收溶剂,采用的方法是。
(4)
与水反应生成
和氢气,在25℃,101
下,已知每消耗3.8克
放热21.6
,该反应的热化学方程式是。
(本题共14分)钢铁是最重要、用量最大的金属材料之一。完成下列计算:
51.生产1吨含铁96%的生铁,至少需要氧化铁含量70%的赤铁矿(杂质不含铁)_____吨。(计算结果保留2位小数)
52.工业炼铁用一氧化碳还原氧化铁时会发生如下一系列反应:
3Fe2O3+CO→2Fe3O4+CO2 Fe3O4+CO→3FeO+CO2 FeO+CO→Fe+CO2
某次实验中,用CO还原4.80 g氧化铁,当固体质量变成4.56 g时,测得此固体中只存在2种氧化物。通过计算确定此固体可能的成分和它们的物质的量之比。
53.为了测定某碳素钢(假设只含铁和碳)的含碳量,将10.000 g钢样完全溶解于过量的热浓硝酸中,产生了0.300 mol气体(假设气体全部逸出,N2O4已折算为NO2)。气体用50.00 mL 12.00 mol/L的NaOH溶液完全吸收后,只生成两种盐,溶液蒸干后得到不含结晶水的固体32.664 g。计算:
(1)钢样的含碳量。
(2)参加反应的硝酸的物质的量。
(一) 尿素又称碳酰胺,是含氮量最高的氮肥,工业上利用二氧化碳和氨气在一定条件下合成尿素。其反应分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵)(l) △H1= -330.0 kJ·mol-1
H2NCOONH4(氨基甲酸铵)(l) △H1= -330.0 kJ·mol-1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l)△H2=" +" 226.3 kJ·mol-1
H2O(l)+H2NCONH2(l)△H2=" +" 226.3 kJ·mol-1
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 m3 密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第步反应决定。
②反应进行到10 min时测得CO2的物质的量如上图所示,则用CO2表示的第一步反应的速率v(CO2)=mol/(L·min)。
③当反应在一定条件下达到平衡,若在恒温、恒容下再充入一定量气体He,则CO(NH2)2(l)的质量_________(填“增加”、“减小”或“不变”)。
(二)氨是制备尿素的原料,NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
氨气溶于水得到氨水,在25℃下,将amol/L的氨水与bmol/L的硫酸以3∶2体积比混合反应后溶液呈中性。用含a和b的代数式表示出氨水的电离平衡常数为_________。
(三)氢气是合成氨的原料。“氢能”将是未来最理想的新能源。
(1)在25℃,101KPa条件下,1 g氢气完全燃烧生成液态水时放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为。
(2)氢气通常用生产水煤气的方法制得。其中C(s)+ H2O(g) CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。
CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。
①当加热到850℃反应达到平衡的标志有______________ 。
| A.容器内的压强不变 |
| B.消耗水蒸气的物质的量与生成CO的物质的量相等 |
| C.混合气的密度不变 |
| D.单位时间有n个H-O键断裂的同时有n个H-H键断裂 |
②x应满足的条件是。
(四)CO2是合成尿素的原料,但水泥厂生产时却排放出大量的CO2。华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
(1)上述生产过程的能量转化方式是。
(2)上述电解反应在温度小于900℃时进行碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为,阴极的电极反应式为。