(本题共14分)钢铁是最重要、用量最大的金属材料之一。完成下列计算:
51.生产1吨含铁96%的生铁,至少需要氧化铁含量70%的赤铁矿(杂质不含铁)_____吨。(计算结果保留2位小数)
52.工业炼铁用一氧化碳还原氧化铁时会发生如下一系列反应:
3Fe2O3+CO→2Fe3O4+CO2 Fe3O4+CO→3FeO+CO2 FeO+CO→Fe+CO2
某次实验中,用CO还原4.80 g氧化铁,当固体质量变成4.56 g时,测得此固体中只存在2种氧化物。通过计算确定此固体可能的成分和它们的物质的量之比。
53.为了测定某碳素钢(假设只含铁和碳)的含碳量,将10.000 g钢样完全溶解于过量的热浓硝酸中,产生了0.300 mol气体(假设气体全部逸出,N2O4已折算为NO2)。气体用50.00 mL 12.00 mol/L的NaOH溶液完全吸收后,只生成两种盐,溶液蒸干后得到不含结晶水的固体32.664 g。计算:
(1)钢样的含碳量。
(2)参加反应的硝酸的物质的量。
钠及其化合物具有广泛的用途。
(1)工业上制备金属钠的常用方法是____________。试写出制备金属钠的化学方程式。金属钠可用于(写出Na在熔点低方面的一种用途)。
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池。该电池的结构如图所示:
①正极的电极反应式为___________,电池工作时物质A可循环使用,A物质的化学式为_____________。
②请写出检验Na2CO3中钠元素的方法。
(3)常温下,浓度均为0.1 mol·L-1的下列五种钠盐溶液的pH如下表:
| 溶质 |
CH3COONa |
Na2CO3 |
NaClO |
NaCN |
| pH |
8.8 |
11.6 |
10.3 |
11.1 |
上述盐溶液的阴离子中,结合H+能力最强的是,根据表中数据,浓度均为0.01 mol·L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是_______(填序号)。
a.HCN b.HClO c.CH3COOHd.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯。
①常温下,当300 mL 1 mol·L-1的NaOH溶液吸收4.48 L(折算成标准状况)SO2时,所得溶液pH>7,则溶液中各离子浓度由大到小的顺序为________________________。
②已知几种离子开始沉淀时的pH如下表:
| 离子 |
Fe2+ |
Cu2+ |
Mg2+ |
| pH |
7.6 |
5.2 |
10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加某浓度的NaOH溶液时,________(填离子符号)先沉淀,Ksp[Fe(OH)2]______Ksp[Mg(OH)2](填“>”、“=”或“<”)。
如下表所示为元素周期表的一部分,参照元素①~⑦在表中的位置,请回答下列问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
||||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
(1)③、④、⑦的原子半径由大到小的顺序为(用元素符号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为(用酸的化学式表示)。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 ;
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
①写出D溶液与G反应的化学方程式。
②写出检验A溶液中溶质的阴离子的方法。
③常温下,若电解1L0.1 mol·L-1的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为。
④写出过量的E与F溶液中溶质反应的离子方程式。
(5)由②、④、⑥元素组成的化合物W(在酸性溶液中发黄,W还原性较强),在溶液中易被⑦的单质氧化,该反应的离子方程式为 。
高铁酸盐是一种强氧化剂,在能源、环保等方面均有广泛的用途。湿法、干法制备高铁酸钾的原理如下表所示:
| 湿法 |
强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
| 干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |
(1)某工厂用湿法制备高铁酸钾的流程如图所示: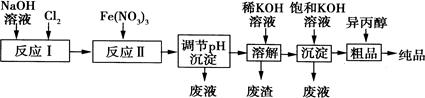
①反应I的化学方程式为。
②反应Ⅱ的离子方程式为。
③已知25℃时Fe(OH)3的Ksp=4.0×10—38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10—5mol·L—1.则需调整pH=时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾。
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2(填“强”或“弱”)。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠(填“大”或“小”)。
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为。
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为。
液晶高分子材料应用广泛。新型液晶基元——化合物Ⅳ的合成线路如下:
(1)化合物Ⅰ的分子式为________,1 mol化合物Ⅰ最多可与________mol NaOH反应。
(2)CH2=CH—CH2Br与NaOH水溶液反应的化学方程式为(注明条件)______________。
(3)化合物Ⅰ的同分异构体中,苯环上一溴代物只有2种且能发生银镜反应的化合物有多种,写出其中一种同分异体的结构简式____________________。
(4)下列关于化合物Ⅱ的说法正确的是_______(填字母)。
| A.属于烯烃 | B.能与FeCl3溶液反应显紫色 |
| C.一定条件下能发生加聚反应 | D.能使溴的四氯化碳溶液褪色 |
(5)反应③的反应类型是________。在一定条件下,化合物 也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ。Ⅴ的结构简式是__________。
也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ。Ⅴ的结构简式是__________。
硫元素有多种化合价,可形成多种化合物。
(1)常温下用1mol•L-1 100 mL NaOH溶液恰好完全吸收0.1mol SO2气体,此反应的离子方程式为;该溶液pH<7的原因是(结合方程式回答)。以石墨作电极,电解该物质的饱和溶液时,只有一个电极产生气体,写出阳极的电极反应式。
(2)请按照浓度由大到小的顺序排列0.1mol/LNa2SO3溶液中的离子。Na2SO3溶液放置于空气中一段时间后,溶液的pH(填“增大”“减小”或 “不变”)。
(3)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。
实验①可说明(填字母)
| A.该Na2S2O3溶液中水电离的c(OH—)=10—8mol/L |
| B.H2S2O3是一种弱酸 |
| C.Na2S2O3是一种弱电解质 |
D.Na2S2O3水解方程式为S2O32—+2H2O H2S2O3+2OH— H2S2O3+2OH— |
写出实验②发生反应的离子方程式。
(4)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。
5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O)。试回答:
①此滴定实验是否需要指示剂(填“是”或“否”),KMnO4溶液置于(填“酸式”或“碱式”)滴定管中。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果(填“偏高”“偏低”或“不变”)。
③产品中Na2S2O3·5H2O的质量分数为。(Na2S2O3·5H2O式量:248)(保留小数点后两位数)