钠及其化合物具有广泛的用途。
(1)工业上制备金属钠的常用方法是____________。试写出制备金属钠的化学方程式 。金属钠可用于 (写出Na在熔点低方面的一种用途)。
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池。该电池的结构如图所示:
①正极的电极反应式为___________,电池工作时物质A可循环使用,A物质的化学式为_____________。
②请写出检验Na2CO3中钠元素的方法 。
(3)常温下,浓度均为0.1 mol·L-1的下列五种钠盐溶液的pH如下表:
| 溶质 |
CH3COONa |
Na2CO3 |
NaClO |
NaCN |
| pH |
8.8 |
11.6 |
10.3 |
11.1 |
上述盐溶液的阴离子中,结合H+能力最强的是 ,根据表中数据,浓度均为0.01 mol·L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是_______(填序号)。
a.HCN b.HClO c.CH3COOH d.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯。
①常温下,当300 mL 1 mol·L-1的NaOH溶液吸收4.48 L(折算成标准状况)SO2时,所得溶液pH>7,则溶液中各离子浓度由大到小的顺序为________________________。
②已知几种离子开始沉淀时的pH如下表:
| 离子 |
Fe2+ |
Cu2+ |
Mg2+ |
| pH |
7.6 |
5.2 |
10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加某浓度的NaOH溶液时,________(填离子符号)先沉淀,Ksp[Fe(OH)2]______Ksp[Mg(OH)2](填“>”、“=”或“<”)。
将下列家庭常用药物与相应作用连线。
板蓝根冲剂伤口消炎
甘草片退热止痛
红霉素抑制胃痛、助消化
扑尔敏抗菌消炎
阿司匹林治疗感冒
碘酒镇咳化痰
胃舒平抗过敏
在 中用虚线标示出氨基酸形成肽键时断裂化学键的位置。
中用虚线标示出氨基酸形成肽键时断裂化学键的位置。
乙醇汽油作为一种新型清洁燃料,是目前世界上可再生能源的发展重点,而且具有较好的经济效益和社会效益,终将成为汽油和柴油的替代品。
(1)写出乙醇完全燃烧的化学方程式:______________________________。
(2)乙醇燃烧时如果氧气不足,可能还有CO生成。用如图装置验证乙醇的燃烧产物中有CO、CO2、H2O,应将乙醇的燃烧产物依次通过(按气流从左到右的顺序填装置编号)________。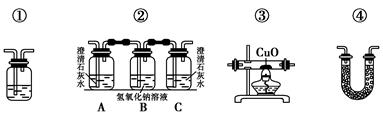
(3)实验时可观察到装置②中A瓶的石灰水变浑浊。A瓶溶液的作用是________;B瓶溶液的作用是________;C瓶溶液的作用是_________________________。
(4)装置③的作用是________;装置①中所盛的是________,作用是______________________。
(5)装置④中所盛的固体药品是________,它可以验证的产物是________。
(6)尾气应如何处理?_________。
(7)海底有大量的甲烷水合物。等质量的甲烷和乙醇完全燃烧产生温室气体CO2较多的是________。
在下列各组气体中,试分析判断哪种气体更易液化?
①Cl2、N2;②SiH4、CH4;③SO2、CO2;④邻二甲苯、对二甲苯;⑤甲烷、乙烷;⑥丁烷、异丁烷
已知M2+3d轨道上有5个电子,试推出:
(1)M原子的核外电子排布。
(2)M原子的最外层和最高能级组中电子数各为多少?
(3)M元素在周期表中的位置。