1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才。现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用如下反应模拟哈伯合成氨的工业化生产:N2(g)+3H2(g) 2NH3(g)△H<0
2NH3(g)△H<0
当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如下图所示。
回答下列问题:
(1)已知:①NH3(g)  NH3(g) △H1
NH3(g) △H1
②N2(g)+3H2(g) 2NH3(l)△H2
2NH3(l)△H2
则反应N2(g)+3H2(g) 2NH3(g)的△H= (用含△H1、△H2的代数式表示)。
2NH3(g)的△H= (用含△H1、△H2的代数式表示)。
(2)合成氨的平衡常数表达式为____ ,平衡时,M点NH3的体积分数为10%,则N2的转化率为 (保留两位有效数字)。
(3)X轴上a点的数值比b点 (填“大”或“小”)。上图中, Y轴表示 (填“温度”或“压强”),判断的理由是 。
(4)若将1mol N2和3mol H2分别投入起始容积为1L的密闭容器中,实验条件和平衡时的相关数据如下表所示:
下列判断正确的是____。
| A.放出热量:Ql< Q2< △Hl | B.N2的转化率:I> III |
| C.平衡常数:II >I | D.达平衡时氨气的体积分数:I>II |
(5)常温下,向VmL amoI.L-l的稀硫酸溶液中滴加等体积bmol.L-l的氨水,恰好使混合溶液呈中性,此时溶液中c(NH4+)__c(SO42-)(填“>”、“<”或“=”)。
(6)利用氨气设计一种环保燃料电池,一极通入氨气,另一极通入空气,电解质是掺杂氧化钇(Y203)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-。写出负极的电极反应式 。
氨气是重要化工产品之一。传统的工业合成氨技术的反应原理是:N2(g)+3H2(g) NH3(g)ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量变化如图所示,回答下列问题:
NH3(g)ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量变化如图所示,回答下列问题:
(1)计算反应在第一次平衡时的平衡常数K= 。(保留二位小数)
(2)产物NH3在5~10 min、25~30min和45~50 min时平均反应速率(平均反应速率分别以v1、v2、v3表示)从大到小排列次序为 。
(3)H2在三次平衡阶段的平衡转化率分别以α1、α2、α3表示,其中最小的是 。
(4)由第一次平衡到第二次平衡,平衡移动的方向是_______,采取的措施是________。
(5)请在下图中用实线表示25~60min 各阶段化学平衡常数K的变化图像。
CO是火力发电厂释放出的主要尾气,为减少对环境污染,发电厂试图采用CO与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:
CO(g) +Cl2(g)  COCl2(g) ΔH =" a" kJ/mol
COCl2(g) ΔH =" a" kJ/mol
反应过程中测定的部分数据如下表:
| t/min |
n (CO)/mol |
n (Cl2)/mol |
| 0 |
1.20 |
0.60 |
| 1 |
0.90 |
|
| 2 |
0.80 |
|
| 4 |
0.20 |
(1)反应0~2min末的平均速率v(COCl2)=______________mol/(L∙min)。
(2)在2min~4min间,v(Cl2)正______________v(Cl2)逆(填“>”、“=”或“<”),该温度下K =_________。
(3)在表格中画出0~4min末n(COCl2)随时间的变化示意图
(4)已知X、L可分别代表温度或压强,下图表示L一定时,CO的转化率随X的变化关系。
X代表的物理量是___________;a_______0 (填“>”,“=”,“<”),依据是___________。
已知甲、乙、丙是中学常见的三种气体单质,相互间反应可制得化肥B。其转化关系如图所示: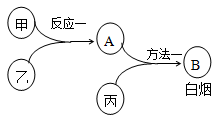
(1)将B中所含元素填写在下表的恰当位置中(用元素符号表示)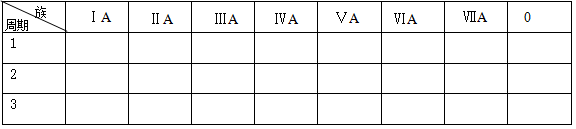
(2)已知反应一是放热反应,画出能量关系示意图。
(3)为加快反应一的速率,可采取的措施有:适当升高温度、选用恰当的催化剂、增大某一反应物的浓度和______________。
(4)方法一的化学方程式是_________________。
(5)用方法二也能制得B:甲和丙反应的产物与A反应即可,这两种方法更好的是______(填“方
法一”或“方法二”),理由是______________。
将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)  2B(g)。在三种不同条件下进行实验,A的物质的量随时间的变化如图所示。试回答下列问题:
2B(g)。在三种不同条件下进行实验,A的物质的量随时间的变化如图所示。试回答下列问题: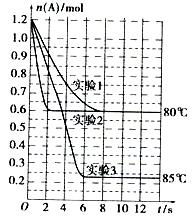
(1)实验1中,4s时A的转化率为 ;此条件下该反应的平衡常数K1的值为 。
(2)实验2与实验1对比,其可能隐含的反应条件是 。
(3)根据实验3与实验1的图象比较,可推测该反应是 (填“放热”或“吸热”)反应。设实验1~3的平衡常数的值分别为K1、K2、K3,则它们之间的关系为K1 K2 K3(填“>”、“<”或“=”)。
(4)为了验证增大催化剂的表面积、增大压强可提高化学反应速率这一结论,某同学在实验1的基础上又利用该容器设计了实验4和实验5,部分实验条件及数据见下表。请将表格补充完整。
| 实验编号 及其目的 |
V(容积)/L |
t/℃ |
n(A起始)/mol |
n(B起始)/mol |
催化剂的质量/g |
催化剂的表面积/m2·g—1 |
| 实验1参照对比实验 |
2 |
80 |
1.2 |
0 |
a |
b |
| 实验4:催化剂的表面积对反应速率的影响 |
|
|||||
| 实验5目的: |
1 |