将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)  2B(g)。在三种不同条件下进行实验,A的物质的量随时间的变化如图所示。试回答下列问题:
2B(g)。在三种不同条件下进行实验,A的物质的量随时间的变化如图所示。试回答下列问题:
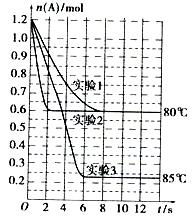
(1)实验1中,4s时A的转化率为 ;此条件下该反应的平衡常数K1的值为 。
(2)实验2与实验1对比,其可能隐含的反应条件是 。
(3)根据实验3与实验1的图象比较,可推测该反应是 (填“放热”或“吸热”)反应。设实验1~3的平衡常数的值分别为K1、K2、K3,则它们之间的关系为K1 K2 K3(填“>”、“<”或“=”)。
(4)为了验证增大催化剂的表面积、增大压强可提高化学反应速率这一结论,某同学在实验1的基础上又利用该容器设计了实验4和实验5,部分实验条件及数据见下表。请将表格补充完整。
| 实验编号 及其目的 |
V(容积)/L |
t/℃ |
n(A起始)/mol |
n(B起始)/mol |
催化剂的质量/g |
催化剂的表面积/m2·g—1 |
| 实验1参照对比实验 |
2 |
80 |
1.2 |
0 |
a |
b |
| 实验4:催化剂的表面积对反应速率的影响 |
|
|
|
|
|
|
| 实验5目的: |
1 |
|
|
|
|
|
(6分) 向1L AlCl3和FeCl3混合溶液中加入2mol /LNaOH溶液300mL时,产生的沉淀量达最大值;继续加入NaOH溶液,沉淀开始溶解,当加入NaOH溶液的总体积达到 350mL时,沉淀不再减少,求原溶液中FeCl3的物质的量浓度(需写出解题过程)。
(4分)除杂(括号内为杂质)
| 序号 |
物质 |
除杂试剂 |
| (1) |
CO2(HCl) |
|
| (2) |
Fe2O3(Al2O3) |
|
| (3) |
NaCl溶液(MgCl2) |
|
| (4) |
NO气体(NO2) |
(12分)实验室可用干燥纯净的氨还原氧化铜来制取氮气。根据下列装置图(部分夹持装置略去)回答有关问题:
(1)装置B中盛放的药品是。
(2)写出装置A中反应的化学方程式______。
(3)写出装置C中反应的化学方程式_________,该反应中的氧化剂是。
(4)收集到的氮气中除了含有少量水蒸气外,还可能含有另外一种气体,确定是否含有该气体的实验方法是,实验室收集氮气的方法是。
用NaCl固体配制1mol/L的NaCl溶液100mL。
(1)实验室有下列仪器:①玻璃棒;②胶头滴管;③100mL量筒;④100mL容量瓶;⑤250mL量筒;⑥托盘天平;⑦50mL烧杯;应选用的仪器(填编号)。
(2)应称取NaCl的质量为。
(3)在定容时,不小心滴加的蒸馏水超过了刻度线,处理的方法是;将NaCl溶液转移到容量瓶后,未对烧杯和玻璃棒进行洗涤,则所得溶液的浓度(填“偏高”或“偏低”或“不变”)。
(10分)(1)向用氯化铁溶液刻制印刷电路后的废液中,加入足量铁粉,发生反应的离子方程式是、。
(2)实验室向某溶液中加入硫氰化钾溶液,无现象,滴加少量氯水,立即变为红色,则原溶液中含有(填离子符号),写出滴加氯水时发生反应的离子方程式。
(3)我们知道,浓硫酸有脱水性、吸水性和氧化性,请写出证明浓硫酸具有氧化性的反应的化学方程式(写一个,多写若有一个错误,本题不得分)。