某待测液中可能含有A13+、Fe3+、K+、NH4+、C1-等离子,现通过如下实验对其中的阳离子进行检验:
(1)取少量待测液,仔细观察,呈无色;
(2)向上述待测液中滴加NaOH溶液,有白色沉淀生成,NaOH溶液过量后沉淀又完全溶解,再加热还有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝。
据此可以判断该待测液中一定含有的阳离子是 ,一定没有的阳离子是 。还有一种阳离子没有检验,检验这种离子的实验方法是(填写实验名称) ,现象是 。
(4分)用电子式表示下列物质
HF:__________________CO2
CaBr2:_______________NaCl
(8分)原子序数11~17的元素,自钠到氯,电子层数相同,最外层电子数从增加到,随着核电荷数依次递增,原子半径依次,核对 外层电子的引力逐渐,失电子能力逐渐,得电子能力逐渐,因此,金属性逐渐,非金属性逐渐。
外层电子的引力逐渐,失电子能力逐渐,得电子能力逐渐,因此,金属性逐渐,非金属性逐渐。
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生 成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。请回答下列
成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。请回答下列 问题:
问题: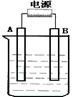
(1)A接的是电源的极,B是该装置的极。
(2)写出电解时反应的总离子方程式
。
(3)电解后溶液的pH为;要使电解后溶液恢复到电解前的状态,则需加入
(填化学式) ,其质量 为。(假设电解前后溶液的体积不变)
为。(假设电解前后溶液的体积不变)
(5分)已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水 平②2CH3CHO+O2
平②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成E,E是一种有香味的有机物,其合成路
2CH3COOH。现以A为主要原料合成E,E是一种有香味的有机物,其合成路 线如下图所示。
线如下图所示。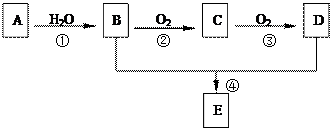
回答下列问题:
(1)B、E分子中的官能团名称分别是、。
(2)写出下列反应的反应类型:④。
(3)写出反应②的化学方程式:。
I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
(1)铁锅的锈蚀是腐蚀(填“析氢”或“吸氧”)。
(2)写出铁锅腐蚀正极的电极反应式:
II.美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,其构造如图所示:a、b两个极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。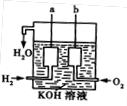
(1)a是__________极;电极反应式为___________________。
(2)已知: ;
;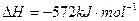 ,
,
飞船上宇航员的生活用水由燃料电池提供。已知这种电池发1度电(3600KJ)时能生成360g水,则该电池的能量的利用率为________.