(每空1分,共8分)低碳经济呼唤新能源和清洁环保能源。煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
850 |
| 平衡常数 |
9.94 |
9 |
1 |
请回答下列问题:
(1)上述正反应方向是 反应(填“放热”或“吸热”)。
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如下图,则0~4 min的平均反应速率v(CO)= mol·L-1·min-1。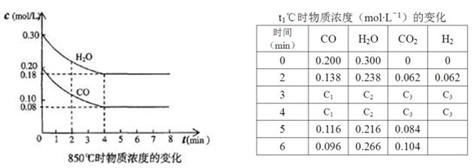
(3)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3 min~4 min之间反应处于 状态;C1数值 0.08 mol·L-1(填大于、小于或等于)。
②反应在4 min~5 min,平衡向逆方向移动,可能的原因是 (单选),表中5 min~6 min之间数值发生变化,可能的原因是 (单选)。
A.增加水蒸气 B.降低温度
C.使用催化剂 D.增加氢气浓度
(4)若在500℃时进行,若CO、H2O的起始浓度均为0.020 mol·L-1,在该条件下,CO的最大转化率为: 。
(5)若在850℃进行,设起始时CO和H2O(g)共为5mol,水蒸气的体积分数为X;平衡时CO转化率为Y,试推导Y随X变化的函数关系式为 。
过量铁粉与稀硝酸反应方程式为:3Fe + 8HNO3 (稀)="=" 3Fe(NO3)2 + 2NO↑ + 4H2O,
(1)该反应的氧化剂是,氧化产物是;
(2)标准状况下,当生成2.24L NO气体时,有g Fe参加反应。
氯气在科技、生产中应用广泛。
(1)工业上常用熟石灰和氯气反应制取漂白粉,化学方程式是___。
(2)实验室用MnO2与浓盐酸反应制取氯气的过程中,可用NaOH溶液吸收尾气,下列试剂也可用于吸收氯气的是____(填字母)。
a.KI溶液 b.FeCl2溶液 c.KCl溶液
写出你选择的一种吸收试剂与Cl2反应的离子方程式:____。
也可用浓氨水吸收氯气,同时生成一种无污染的气体,反应的化学方程式是____。
(3)以粗盐为原料制备亚氯酸钠(NaClO2)的工艺流程如下
写出二氧化氯发生器中生成二氧化氯的离子方程式。
(4)FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
a.检验装置的气密性;
b.通入干燥的Cl2,赶尽装置中的空气;
c.用酒精灯在铁屑下方加热至反应完成;
d.在沉积的FeCl3固体下方加热
e.体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
①装置D中FeCl2的作用是,写出检验FeCl3的离子方程式。
②画出尾气吸收装置E并注明试剂。
③该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫,FeCl3与H2S反应的离子方程式为________________。
太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层。
(1)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示。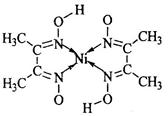
该结构中,
①氮镍之间形成的化学键是________;从原子轨道重叠的方式看,碳碳之间的共价键类型是σ键,则碳氮之间的共价键类型是。
②碳原子的杂化轨道类型有。
③氧氢两元素之间除共价键外还可能存在_______________;
(2)过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=;CO与N2互为等电子体.CO的总键能大于N2的总键能,但CO比N2容易参加化学反应.根据下表数据,说明CO比N2活泼的原因是 。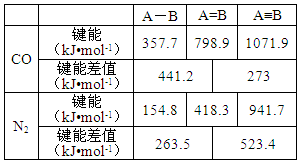
(3)甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醇分子内的O—C—H键角(填“大于”“等于”或“小于”)甲醛分子内的O—C—H键角。
(16分)根据题目要求作答:
(1)下列曲线表示卤族元素某种性质随核电荷数递增的变化趋势,正确的是。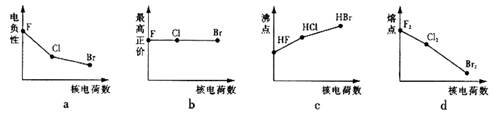
(2)下列物质变化,只与范德华力有关的是。
A.干冰熔化
B.冰的汽化
C.乙醇与水混溶
D.碘溶于四氯化碳
E.石英熔融
(3)已知0.1 mol CrCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.2 mol AgCl沉淀。此配合物最有可能的化学式是。
A.[Cr(H2O)6]Cl3B.[Cr(H2O)5Cl]Cl2·H2O
C.[Cr(H2O)4Cl2]Cl·2H2OD.[Cr(H2O)3Cl3]·3H2O
(4)金属镍在电池、合金、催化剂等方面应用广泛。Ni是元素周期表中第28号元素。
①第2周期基态原子未成对电子数与Ni相同且电负性最小的元素是;
②NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
③CO与N2结构相似,CO分子内σ键与π键个数之比为。Ni、Fe、Co等金属都能与CO反应形成配合物 ,Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属
于(填晶体类型 )。
④普鲁士蓝是一种配合物,可用作染料,它的晶胞结构如图所示(其中K+在体心位置,未标出),普鲁士蓝中 n(Fe3+)∶n(CN一)= _____。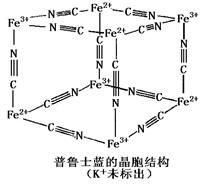
下表为长式周期表的一部分,其中的编号代表对应的元素。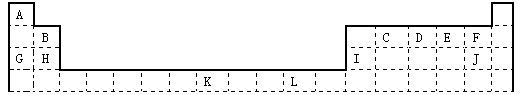
试填空。
(1)写出元素D与A形成的化合物的电子式,该化合物分子的空间构型是,其中元素D的杂化方式为。
(2)J的离子结构示意图;K元素在周期表的位置。元素L基态原子的电子排布式。
(3)E、H、I 这三种元素的第一电离能由大到小的顺序是(填对应的元素符号);
(4)由D、J的氢化物相互作用所生成的物质所含化学键有下列的。
A、离子键
B、非极性键
C、极性键
D、金属键
E、配位键
(5)用氢键表示式写出F的氢化物水溶液中所有氢键