(每空1分,共6分)下面是某科学兴趣小组的同学做同周期元素性质递变规律实验时,设计的一套实验方案。其中实验步骤如下:
请整理并完成实验报告:
(1)实验目的: 。
(2)实验用品:
试剂:金属钠、镁条、铝条、稀盐酸、新制氯水、新制Na2S溶液、AlCl3溶液、NaOH溶液等。
仪器: 、酒精灯、表面皿、试管夹、镊子、小刀、玻璃片、砂纸等。
(3)实验内容(完成下列表格中的未完成的实验现象和化学方程式):
| 实验序号 |
实验现象 |
化学方程式 |
| ① |
有气体产生,溶液变成浅红色 |
|
| ② |
生成浅黄色沉淀 |
Na2S+Cl2=2NaCl+S↓ |
| ③ |
|
2Na+2H2O=2NaOH+H2↑ |
| ④ |
剧烈反应,迅速产生无色气体 |
Mg+2HCl=MgCl2+H2↑ |
| ⑤ |
反应不十分剧烈,产生无色气体 |
2Al+6HCl=2AlCl3+3H2↑ |
| ⑥ |
开始时生成白色胶状沉淀,继而沉淀消失 |
AlCl3+3NaOH=Al(OH)3↓+3NaCl Al(OH)3+NaOH=NaAlO2+2H2O |
(4)实验结论: 。
(5)请用原子结构的知识简单解释上述结论: 。
某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹).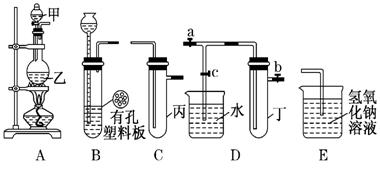
请按要求填空:
(1)仪器甲的名称是__________________;
(2)利用B装置可制取的气体有_________;(写出一种即可).
(3) A、C、E相连后 的装置可用于制取Cl2并进行相关的性质实验.
的装置可用于制取Cl2并进行相关的性质实验.
若在丙中加入适量水,即可制得氯水.将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下:
| 实验序号 |
实验操作 |
现象 |
结论 |
| Ⅰ |
将氯水滴入品红溶液 |
溶液褪色 |
氯气与水反应的 产物有漂白性 |
| Ⅱ |
氯水中加入 碳酸氢钠粉末 |
有无色气泡产生 |
氯气与水反应的 产物具有酸性 |
请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理的请直接说明理由
实验Ⅰ___________________________________________________
实验Ⅱ_______________________ _____________________________.
_____________________________.
(4)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得并进行NO2有关实验.
①欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹a和b,再打开止水夹c,使烧杯中的水进入试管丁的操作是_______.
②试管丁中集满NO2,再与水充分反应后,向试管内缓缓通入一定量的氧气,直到试管内全部充满水,则所得溶液中溶质的物质的量浓度是_______mol/L(气体按标准状况计算).
农民使用的氮肥主要是“氢铵”和尿素。某化学兴趣小组对某“氢铵”化肥进行了专项研究: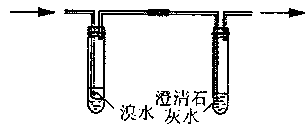
(1)预测:根据已有知识和“氢铵”的名称,该小组预测该“氢铵”是碳酸或亚硫酸或硫酸的铵盐。
(2)验证和探究:①NH4+的验证:取少量固体药品于试管中,然后。
②阴离子的探究: a.取少量固体药品于试管中,然后向试管中滴加稀盐酸,固体全部溶解,将
产生的气体通入下列装置。观察到的现象是:溴水无明显变化,澄清石灰水变浑浊。
再向滴加稀盐酸反应后的试管中,加Ba(OH)2溶液,无明显现象。
Ⅰ.初步结论:“氢铵”是的铵盐。
Ⅱ.要进一步确定“氢铵”的成分还需要补做如下实验:取适量“氢铵”配制成溶液,取试液于一支洁净的试管中,。
(3)该实验小组设计了以下二个实验方案测定该化肥的含氮量,请你阅读后解释方案中提出的问题并进行评价:
方案(一):准确称取一定质量的样品,放入上图方案(一)的烧瓶中,滴加过量NaOH浓溶液,充分微热,按如图装置,通过实验测定烧杯增加的质量(忽略漏斗中附着溶液的质量)。然后进行计算,可得化肥的含氮量。
方案(二):准确称取一定质量的样品,放入上图方案(二)的烧瓶中,滴加过量NaOH浓溶液,充分微热,按如图装置(A管可以上下移动),测量生成的氨气体积(设所测体积为标准状况下的体积)。然后进行计算,可得化肥的含氮量。
方案(二)图中导管a的作用是。
请你评价上述两套方案是否合理。若合理只需要说明结论;若不合理,请简要说明原因,并指出修改方案(若要添加仪器、药品,请说明添加的位置、名称)
方案(一):
方案(二):
氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用。
(1)下图是1mol NO2气体和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2气体和CO反应的热化学方程式:。
(2)在固定体积的密闭容器中,进行如下化学反应: N2(g) +3H2(g) 2NH3(g);
2NH3(g);
①下列各项能说明该反应一定达到平衡状态的是(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(H2)(逆) =)3v(N2)(正)
c.容器内压强保持不变 d.混合气体的密度保持不变
②若上述反应达到平衡时,N2、H2、NH3的浓度之比为1:3:2,再向容器中按物质的量之比为1:3:2通入N2、H2、NH3,与原平衡相比,N2的物质的量浓度(填增大、不变或减小,下同),NH3的体积分数。
(3)科学家一直致力研究常温、常压下“人工固氮”的新方法。请回答下列问题:
目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g);△H<0。
2NH3(g);△H<0。
①下图表示随条件改变,平衡混合气体中氨气的百分含
量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号,下同)_____________;当横坐标为温度时,变化趋势正确的是_________________。
②液氨与水相似,存在着微弱的电离,写出液氨发生电离的方程式: ___________________________
下图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑、6 mol/L H2SO4溶液和NaOH溶液。填写下列空白: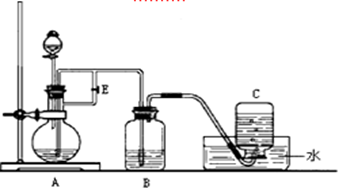
(1)B中盛有一定量的,A中应预先加入的试剂是,A中反应的化学方程式为。
(2)实验开始时应先将活塞E(填“打开”或“关闭”),目的是。
(3)A反应一段时间后将活塞E(填“打开”或“关闭”),目的是
。
(4)实验结束,拔去装置B中的橡皮塞,使空气进入,Fe(OH)2被氧化。若反应过程中转移了0.04mol电子,则参加反应的氧气的体积为L(标准状况)。
用18mol/L 浓硫酸配制100ml 3.0mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积,②量取一定体积的浓硫酸,③溶解,④检漏、转移、洗涤,⑤定容、摇匀。回答下列问题:
(1)所需浓硫酸的体积是(保留到小数点后一位),量取浓硫酸所用的量筒的规格是(从下列中选用:A. 10ml B. 25ml C. 50ml D. 100ml)
(2)在上述实验步骤中,需要用到 玻璃棒的有(填序号)。
玻璃棒的有(填序号)。
(3)第⑤步实验的操作是:继续向容量瓶注入蒸馏水至离刻度线1-2cm处,改用胶头滴管向容量瓶滴加至为止。塞紧瓶塞,倒转摇匀。
(4)下列情况对所配制的稀硫酸浓度有何影响?(填“偏大”、“偏小”或“无影响”)
A. 所用的浓硫酸长时间放置在密封不好的容器中
B. 容量瓶用蒸馏水洗涤后残留有少量的水
C. 所用过的烧杯、玻璃棒未洗涤
D. 定容时俯视溶液的凹液面