氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式 。
(2)已知:N2(g)+ O2(g)=" 2" NO(g) △H = +180 kJ • mol-1
2NO(g)+2 CO(g)= N2(g) + 2 CO2(g) △H =" -" 746 kJ • mol-1
则反应CO(g) + O2(g)= CO2(g)的△H = kJ • mol-1
O2(g)= CO2(g)的△H = kJ • mol-1
(3)在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应: N2(g)+3H2(g) 2NH3(g) △H <0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 ,该反应的平衡常数表达式K = 。
2NH3(g) △H <0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 ,该反应的平衡常数表达式K = 。
(4) 在固定体积的密闭容器中,1.0×103 kPa时反应 N2(g)+3H2(g) 2NH3(g)
2NH3(g)
△H<0 的平衡常数K与温度T的关系如下表:
| T/K |
298 |
398 |
498 |
| 平衡常数K |
51 |
K1 |
K2 |
①K1 K2(填写“>”、“=”或“<”)
②下列各项能说明上述合成氨反应一定达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.NH3的浓度保持不变
c.容器内压强保持不变 d.混合气体的密度保持不变
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的元素。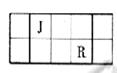
(1)元素T在周期表中的位置是位于①_________。
(2)J和氢组成的化合物A每个分子由4个原子组成且含有2个氢原子,其结构式为②________________,已知充分燃烧a gA物质时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则A物质燃烧热的热化学方程式是③__________。
(3)M和R形成的一种化合物能使酸性高锰酸钾溶液褪色,该反应的离子方程式为④______________。
(4)在微电子工业中,L的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为:⑤。
(5)写出三种仅由上述五种元素中的一种或两种元素形成的漂白剂的化学式:⑥ __________________。
(6)其中L、M、R形成的氢化物沸点由高到低的顺序是⑦(用化学式表示)
有A、B、C、D四种短周期元素,它们的原子序数依次增大,A和B在同一周期,A的电子式为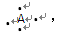 B原子L层的电子总数是K层的3倍,0.1molC的单质从酸中置换出2.24L氢气(标准状况),同时它变成了与Ne原子电子层结构相同的微粒,D离子的半径比C离子的小,D离子与B离子的电子层结构相同。(D是常用金属之一)
B原子L层的电子总数是K层的3倍,0.1molC的单质从酸中置换出2.24L氢气(标准状况),同时它变成了与Ne原子电子层结构相同的微粒,D离子的半径比C离子的小,D离子与B离子的电子层结构相同。(D是常用金属之一)
(1)写出A、B、C、D元素的名称①,②,③,④.
(2)D元素在周期表中的位置属第⑤_____周期⑥___________族.
(3)用电子式表示A的气态氢化物的形成过程⑦______________
(4)A和B的单质充分反应的生成物的结构式是⑧______________
(5)四种元素中, ⑨________的最高价氧化物对应的水化合物既溶于酸又能溶于碱,溶于NaOH溶液的化学方程式为⑩___________________________________________.
、将VmLNO和NO2的混合气体通过水吸收后,得到amL无色气体A。将此无色气体A与等体积的O2混合,再通过水充分吸收后,收集到5mL无色气体B。试回答:
⑴气体A是①;气体B是②。
⑵A气体的体积是③毫升。
A、B、C、D、E五种物质在一定条件下的转化关系如图所示。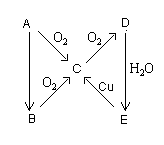
(1)若A是空气中很稳定的主要气态单质,B气体遇湿润的红色石蕊试纸变蓝,C为无色气体,D为红棕色气体。则A为①____;B为②___;C为③___;D为④___;E为⑤___;A的电子式⑥_______; B的结构式⑦_____由D→E变化的化学方程式⑧_______________________________.
由E→C变化的离子方程式是⑨_______________________________________.
(2)若A在常温下为淡黄色固态单质。B为A的氢化物,则E→C变化的化学方程式⑩__________________________________________
【化学—选修5:有机化学基础】
A是生产某新型工程塑料的基础原料之一,由C、H、O三种元素组成,其分子结构模型如图所示(图中球与球之间连线代表化学键单键或双键)。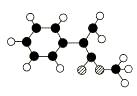
Ⅰ.根据分子结构模型写出A的分子式,A的核磁共振氢谱有_______个吸收峰。
Ⅱ.以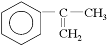 为主要原料合成A的路线如下:
为主要原料合成A的路线如下: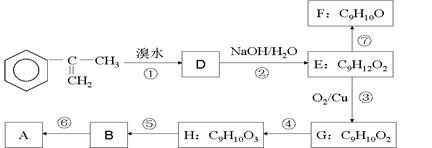
(1)下列反应的反应类型:④⑥ ;
(2)H的结构简式为___________,B中官能团的名称为;
(3)写出反应②的化学方程式(注明必要的条件)
(4)已知烯醇式不稳定,会转化为醛:R—CH="CH—OH" → R—CH2—CHO。反应⑦生成的有机物有两种可能,它们的结构简式分别为、,要把它们区别开来,可使用的试剂是。