已知Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH <0;则下列关于该反应的叙述不正确的是
| A.反应物的总能量高于生成物的总能量 |
| B.上述热化学方程式中的ΔH的值与反应物的用量无关 |
| C.该反应的化学能可以转化为电能 |
| D.该反应中旧键断裂吸收能量,新键形成放出能量,所以物质的总能量不变 |
一定条件下,中学化学常见物质甲、乙之间存在如下转化关系,乙是
| A.HCl | B.NaHCO3 | C.KOH | D.FeCl2 |
广口瓶被称为气体实验的“万能瓶”,是因为它可以配合玻璃管和其他简单仪器组成各种功能的装置。下列图中各装置可用作测量气体体积的是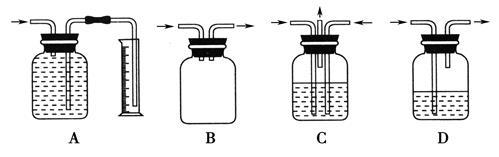
下列有关化学用语表达正确的是
| A.二氧化硅的分子式:SiO2 |
B.HClO的电子式: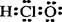 |
C.乙酸分子的球棍模型: |
D.离子结构示意图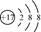 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- |
一定温度下,在三个体积均为2.0L的恒容密闭容器中发生如下反应:PCl5(g) PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
| 编号 |
温度(℃) |
起始物质的量 (mol) |
平衡物质的量 (mol) |
达到平衡所需时间(s) |
|
| PCl5(g) |
PCl3(g) |
Cl2(g) |
|||
| Ⅰ |
320 |
0.40 |
0.10 |
0.10 |
t1 |
| Ⅱ |
320 |
0.80 |
t2 |
||
| Ⅲ |
410 |
0.40 |
0.15 |
0.15 |
t3 |
下列说法正确的是()
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器I中的平均速率为v(PCl5)=0.1/t1 mol/(L•s)
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则反应将向逆反应方向进行
化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是()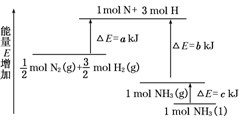
| A.N2(g)+3H2(g)═2NH3(l)△H=2(a-b-c)kJ/mol |
| B.N2(g)+3H2(g)═2NH3(g)△H=2(b-a)kJ/mol |
| C.1/2N2(g)+ 3/2H2(g)═NH3(l) △H=(b+c-a)kJ/mol |
| D.1/2N2(g)+ 3/2H2(g)═NH3(g)△H=(a+b)kJ/mol |