如何实现化石燃料的综合利用,减少化石燃料燃烧所造成的环境污染,是人类面临的重大挑战。下列关于化石燃料的说法不正确的是( )
| A.天然气除可用作清洁能源外,也可用于合成氨和生产甲醇等 |
| B.煤的气化是指将固态煤粉碎成气态煤,以使煤燃烧时能与氧气充分接触而完全燃烧 |
| C.石油分馏得到的汽油和石油催化裂化得到的汽油的成分和化学性质不相同 |
| D.化石燃料也是重要的化工原料,乙烯和苯就是分别来自于石油和煤的基本化工原料 |
将a L乙炔、b L苯、c L苯乙烯三者混合,它们所形成的混合物中碳、氢两元素的质量比是
| A.1:12 | B.1:6 | C.12:1 | D.6:1 |
下列离子方程式正确的是
| A.乙酸与碳酸钠溶液反应:2H++CO32—="=" CO2↑+H2O |
| B.醋酸溶液与新制氢氧化铜反应: CH3COOH+OH-→ CH3COO-+H2O |
| C.苯酚钠溶液中通入少量二氧化碳: 2C6H5O- +CO2+H2O → 2C6H5OH+CO32— |
| D.甲醛溶液与足量的银氨溶液共热:HCHO + 4[Ag(NH3)2]+ + 4OH— → CO32—+2NH4++ 4Ag↓+ 6NH3↑ + 2H2O |
由2—氯丙烷制得少量的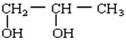 需要经过下列几步反应
需要经过下列几步反应
| A.加成→消去→取代 | B.消去→加成→水解 |
| C.取代→消去→加成 | D.消去→加成→消去 |
下列做法不能达到除杂目的的是
| A.乙酸乙酯(乙酸):加饱和Na2CO3溶液,振荡静置后,分液 |
| B.乙醇(水):加入新制生石灰,蒸馏 |
| C.乙酸(乙醇):加入金属钠,蒸馏 |
| D.溴苯(溴):加入NaOH溶液,充分振荡静置后,分液 |
下列化合物分子中,在核磁共振氢谱图中能给出三种信号峰的是
| A.CH3CH2CH3 | B.CH3COCH2CH3 | C.CH3CH2CH2OH | D.CH3OCH3 |