在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论正确的是( )
| 测定时刻/s |
t1 |
t2 |
t3 |
t4 |
| c(A)/(mol·L-1) |
6 |
3 |
2 |
2 |
| c(B)/(mol·L-1) |
5 |
3.5 |
3 |
3 |
| c(C)/(mol·L-1) |
1 |
2.5 |
3 |
3 |
A.在t3 时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为2A+B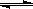 2C
2C
D.在t2~t3内A的平均反应速率为1mol·L-1·s-1
下列物质的分类依据正确的是()
| 物质类别 |
分类依据 |
|
| A |
酸 |
电离时能否产生氢离子 |
| B |
碱性氧化物 |
是否属于金属氧化物 |
| C |
胶体 |
能否发生丁达尔现象 |
| D |
强电解质 |
在水溶液中或熔化状态下能否完全电离 |
“神舟七号”的燃料是氢化锂三兄弟:LiH、LiD、LiT。其中Li的质量数为7,则对相同物质的量的这三种物质的下列说法正确的是()
A.质子数之比为1:2:3 B.中子数之比为1:1:1
C.摩尔质量之比为8:9:10 D.化学性质不相同
中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末和氯化钠。该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些理解,其中错误的是()
| A.金刚石属于金属单质 | B.制造过程中元素种类没有改变 |
| C.CCl4是一种化合物 | D.这个反应是置换反应 |
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如下图所示。据图分析,下列判断不正确的是
| A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2] |
| B.加适量NH4 Cl固体可使溶液由a点变到b点 |
| C.c、d两点代表的溶液中c(H+ )与c(OH-)乘积相等 |
| D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和 |
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液浓度和混合所得溶液的pH如下表所示:
| 实验编号 |
c(HA)/ mol·L-1 |
c(NaOH)/ mol·L-1 |
混合液的pH |
| ① |
0.2 |
0.1 |
pH>7 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.1 |
0.1 |
pH=9 |
下列说法中,不正确的是
A.由实验①可知,HA为弱酸;
B.实验①所得混合溶液:c(Na+)>c(A-)>c(OH-)>c(H+)
C.实验②所得混合溶液:c(Na+)=c(A-)
D.实验③所得混合溶液中由水电离出的OH-的浓度为1×10-9 mol·L-1