某工厂用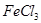 溶液腐蚀镀有铜的绝缘板生产印刷电路,发生反应的化学方程式为:
溶液腐蚀镀有铜的绝缘板生产印刷电路,发生反应的化学方程式为: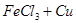 ======
======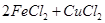 。实验小组的同学对生产印刷电路板的废液成分进行了如下探究:
。实验小组的同学对生产印刷电路板的废液成分进行了如下探究:
①取少量废液,滴加KSCN溶液显红色。
②取10mL废液,加入足量的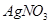 溶液,析出沉淀8.6l g。
溶液,析出沉淀8.6l g。
③另取10mL废液,加入一定质量的铜片,充分反应后,测得铜片的质量减少了0.256g
再向反应后的溶液中滴加KSCN溶液不变色。
根据探究实验得出结论:
(1)废液中含有的金属离子是 。
(2)根据有关数据计算该厂使用的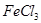 溶液中溶质的物质的量浓度(假设腐蚀电路板后溶液体积不变。写出计算过程)。
溶液中溶质的物质的量浓度(假设腐蚀电路板后溶液体积不变。写出计算过程)。
(3)10mL废液中铜离子的物质的量是 mol。
下列是某无色水样成分的检验,已知该水样中只可能含K+、Mg2+、Fe3+、Cu2+、Ag+、Ca2+、C 、S
、S 、Cl-中的若干种离子,该小组同学取100 mL水样进行实验:向样品中先滴加硝酸钡溶液,再滴加1 mol·L-1硝酸,实验过程中沉淀质量的变化如下图所示:
、Cl-中的若干种离子,该小组同学取100 mL水样进行实验:向样品中先滴加硝酸钡溶液,再滴加1 mol·L-1硝酸,实验过程中沉淀质量的变化如下图所示:
(1)水样中一定含有的阴离子是 ,其物质的量浓度之比为 。
(2)写出BC段曲线所表示反应的离子方程式:
。
(3)由B点到C点变化过程中消耗硝酸的体积为 。
(4)试根据实验结果推测K+是否存在? (填“是”或“否”);若存在,K+的物质的量浓度c(K+)的范围是 (若K+不存在,则不必回答)。
(5)设计简单实验验证原水样中可能存在的离子:(写出实验步骤、现象和结论)
。
X、Y、Z三种物质有如下转化关系: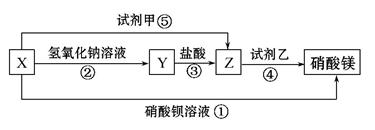
(1)根据上述转化关系,写出下列物质的化学式:
X 、Y 、Z ;试剂甲 ,试剂乙 。
(2)写出上述各步反应①~⑤的离子方程式:
① ;
② ;
③ ;
④ ;
⑤ 。
某化合物的化学式为(NH4)2Fe(SO4)2,它在水溶液里电离时生成两种阳离子和一种酸根离子。
(1)写出(NH4)2Fe(SO4)2的电离方程式 。
(2)该化合物中氮元素与铁元素的质量比为 。
(3)若向该化合物的水溶液中通入氯气,一种离子很容易被氧化,该离子将变成(用离子符号表示) 。
(4)若向该溶液中加入过量的氨水,只能发生一个离子反应,则该反应的离子方程式为 。
下图表示的是向Na2CO3溶液中滴入稀盐酸时产生CO2的过程。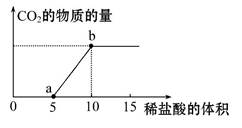
(1)写出a点以前发生反应的化学方程式:
。
(2)写出a到b点发生反应的化学方程式:
。
(3)若某Na2CO3溶液中含mmol Na2CO3,向其中滴入一定量的稀盐酸,恰好使溶液中Cl-和HC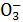 的物质的量浓度之比为2∶1,则滴入的稀盐酸中的HCl的物质的量等于 mol(用含字母m的代数式表示)。
的物质的量浓度之比为2∶1,则滴入的稀盐酸中的HCl的物质的量等于 mol(用含字母m的代数式表示)。
已知物质A、B、C、D、E、F在一定条件下的关系如下图所示,该六种物质的焰色反应均呈黄色。
(1)写出下列物质的化学式:A 、D 、F 。
(2)A、B、C、D四种物质分别长期暴露在空气中,其最终产物为 ,其中变质过程中有氧化还原反应发生的物质是(填写物质对应的化学式)
_________________________________________________________________。
(3)将C加入CuSO4溶液中,发生反应的化学方程式为 。