X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子多1。下列说法正确的是( )
| A.元素X、Y的氢化物沸点Y的较高 |
| B.Z元素最高价氧化物对应水化物的化学式可表示为HYO4 |
| C.Y单质可在X的单质存在时燃烧产生化合物YX3 |
| D.离子半径Z>Y |
把Mmol H2和N mol C2H4混合,在一定条件下使它们一部分发生反应生成W mol C2H6,将反应后的混合气体完全燃烧,消耗氧的物质的量为()
| A.M+3N | B.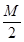 +3N +3N |
C.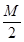 +3N+ +3N+ W W |
D.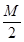 +3N— +3N— W W |
有关晶体的下列说法中正确的是()
| A.晶体中分子间作用力越大,分子越稳定; | B.原子晶体中共价键越强熔点越高; |
| C.冰熔化时水分子中共价键发生断裂; | D.氯化钠熔化时离子键未被破坏 |
根据下表给出的几种物质的溶沸点数据,判断下列说法中错误的是()
| NaCl |
MgCl2 |
AlCl3 |
SiCl4 |
单质B |
|
| 熔点/℃ |
810 |
710 |
180 |
-68 |
2300 |
| 沸点/℃ |
1465 |
1418 |
160 |
57 |
2500 |
A、SiCl4是分子晶体; B、单质B可能是原子晶体;
C、AlCl3加热能升华; D、NaCl 比MgCl2更易熔化
下列说法中正确的是()
| A.某元素原子的最外层只有一个电子,它跟卤素结合时,一定形成离子键 |
| B.离子化合物中的阳离子都是金属离子 |
| C.离子化合物中,一个阴离子可同时与多个阳离子之间产生静电作用 |
| D.溶于水可以导电的化合物一定是离子化合物 |
将淀粉加入试管里,加适量的水,振荡,加热煮沸,取所得溶液3 mL,加15滴3 mol/L的硫酸溶液,加热半分钟,冷却后加入新制的Cu(OH)2浊液,加热后未见红色沉淀,其原因是()
①淀粉水解时未用浓硫酸作催化剂②加入Cu(OH)2浊液之前,未用NaOH溶液中和硫酸③制Cu(OH)2时,硫酸铜溶液太稀④加热时间不充分,淀粉没有水解⑤所用淀粉浓度不够
| A.①② | B.②④ | C.①⑤ | D.③⑤ |