某有机物X催化氧化的产物是(CH3)2CHCHO,有机物X是
| A.乙醇的同系物 | B.乙醛的同系物 |
| C.丙醇的同分异构体 | D.丙醛的同分异构体 |
已知A2+、B+、C3—、D—是第三周期元素的四种离子。下列叙述中正确的是
A.四种离子都具有相同的电子层结构
B.原子半径:r(D)> r(C)> r(A)> r(B)
C.离子半径:r(B+)> r(A2+)> r(C3—)> r(D—)
D.B、D两元素的最高价氧化物的水化物在溶液中反应的离子方程式可表示为H++OH—=H2O
对于溶液中某些离子的检验及结论一定正确的是
| A.加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32- |
| B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C.加入氢氧化钠溶液,加热,产生使湿润的红色石蕊试纸变蓝的气体,一定有NH4+ |
| D.加入氨水直至氨水过量,先产生白色沉淀,后沉淀消失,一定有Al3+ |
某实验过程如图所示:
下列有关图③中出现的现象及解释合理的是
| A.铜片溶解,因铜与稀H2SO4反应生成SO2 |
| B.铜片溶解,产生无色气体,该气体为H2 |
| C.无明显现象,因稀H2SO4不与铜反应 |
| D.铜片溶解,产生无色气体,该气体在试管口变为红棕色 |
A、B、C、D是含同一元素的四种物质,它们相互之间有如下图的转化关系,图中反应所需的条件均已省略,其中D为某种酸或碱。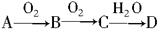
则A不可能是下列物质中的
A.S B.NH3 C.Fe D.Na
下列说法正确的是
A.在粗硅的制取中发生反应2C+SiO2 2CO↑+Si,所以金属性C>Si 2CO↑+Si,所以金属性C>Si |
B.由Na2CO3+SiO2 CO2↑+Na2SiO3可知硅酸的酸性大于碳酸 CO2↑+Na2SiO3可知硅酸的酸性大于碳酸 |
| C.用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2 |
| D.由H2S+CuSO4==CuS↓+H2SO4可知,氢硫酸的酸性比硫酸强 |