(12分)有A 、B 、C 、D四种元素,A元素形成的-2价阴离子比氦原子的核外电子数多8个,B 元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质,C为原子核内有12个中子的二价金属,当2 .4克C与足量热水反应时,在标准状况下放出气体2.24L ,D的M层上7个电子。
(1)写出A的原子结构示意图: 。B的离子结构示意图:
(2)分别写出B 、D的最高价氧化物的水化物的化学式______,_______.
(3)用电子式表示B与D形成的化合物的过程:
(4)C与D两元素最高价氧化物的水化物反应的离子方程式
有三种透明且不溶于水的坚硬固体,A固体在氧气中完全燃烧只能得到一种无色气体,此气体能使澄清石灰水变浑浊,标准状况时测得此气体密度为氧气密度的1.375倍。B固体能溶于苛性钠溶液,再往该溶液中加入过量盐酸时,析出白色胶状沉淀,此沉淀干燥后,得到不溶于水的白色粉末,它是一种比碳酸还弱的酸。将B与石灰石、纯碱按比例混合加热后,能得到C,C在高温时软化,无固定熔点。
根据上述事实,判断A、B、C各为何物。
A;B;C。
写出有关反应的化学方程式。
在氮化硅中添加氧化铝,用氧原子取代一部分氮,用铝原子取代一部分硅,通过常压烧结即成为新一代无机非金属材料,叫氧氮化硅铝,即赛伦(Sialon),化学通式为Si6-xAlxOxNy(x:2~4)。
(1)判断赛伦属于晶体类型,并且有等特性(至少写出三种)。
(2)化学通式里y值为(用含x的表达式或某一具体数值表示)。
1985年,科学家发现C60分子是由60个碳原子构成的,它的形状像足球(图C),因此又叫足球烯。1991年科学家又发现一种碳的单质——碳纳米管,它是由六边环形的碳原子构成的管状大分子(图D),图A、图B分别是金刚石和石墨的结构示意图。图中小黑点或小黑圈均代表碳原子。
试回答下列问题:
(1)金刚石、石墨、足球烯和碳纳米管物理性质存在较大差异的原因是 。
(2)常温下足球烯和碳纳米管的化学性质是否比金刚石和石墨活泼?____________(填“活泼”和“一样”)理由是 。
(3)由下边石墨的晶体结构俯视图可推算在石墨晶体中,每个正六边形平均所占有的C原子数与C—C键数之比为 。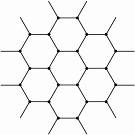
(4)在金刚石的网状结构中,含有共价键形成的碳原子环,其中最小的环上有_____(填数字)个碳原子,每个碳原子上的任两个C—C键的键角都是 (填角度)。
(5)燃氢汽车之所以尚未大面积推广,除较经济的制氢方法尚未完全解决外,还需解决制得H2后的贮存问题,在上述四种碳单质中有可能成为贮氢材料的是 。
A、B、C、D是按原子序数由小到大排列的第2、3周期的元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如下(图中部分产物未列出):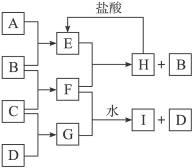
请填写下列空白:
(1)A是______________________,C是______________________。
(2)H与盐酸反应生成E的化学方程式是______________________________________。
(3)E与F反应的化学方程式是______________________________________________。
(4)F与G的水溶液反应生成I和D的离子方程式是____________________________。
在右图中填上元素周期表中与硅上下相邻、左右相邻的元素符号,并完成下列问题:
(1)其中最高价氧化物对应的水化物酸性最强的元素是_________,酸的化学式为______________。
(2)硅酸的酸性比_____________、_____________强,比_____________、____________弱。