工业上合成氨是在一定条件下进行如下反应:N2(g) + 3H2(g) ≒ 2NH3(g),其部分工艺流程如下: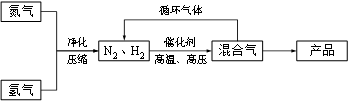
回答下列问题:
(1) 已知: N2(g) + O2(g) 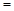 2NO(g) ΔH
2NO(g) ΔH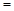 +180.5kJ/mol
+180.5kJ/mol
4NH3(g) + 5O2(g) 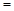 4NO(g) + 6H2O(g) ΔH
4NO(g) + 6H2O(g) ΔH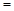 −905kJ/mol
−905kJ/mol
2H2(g) + O2(g) 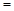 2H2O(g) ΔH
2H2O(g) ΔH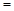 −483.6kJ/mol
−483.6kJ/mol
则N2(g) + 3H2(g) ≒ 2NH3(g) ΔH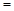 ________________。
________________。
(2) 如果工业上,在一定温度下,将1.5 mol N2气体和6 mol H2气体通入到体积为1升的密闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为_______。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是__________。
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3) 合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过降低混合气体的温度而使氨气分离出来。这种分离物质的方法其原理类似于下列方法中的________(填编号),其理由是__________。
①过滤 ②蒸馏 ③渗析 ④萃取
(4) 可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成分为氯化铵)生成,该反应的化学方程式为__________。
(5) 假如该厂生产氨水的物质的量浓度为20 mol/L,实验室若需用80 mL浓度为5 mol/L的氨水时,需取20 mol/L的氨水__________mL(用100 mL的容量瓶)。假如该氨水的 ,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________
,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________ (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
味精厂、化肥厂、垃圾渗滤液等排放的废水中往往含有高浓度的氨氮,若不经处理直接排放会对水体造成严重的污染。
(1)生物硝化法:在富氧条件下,通过硝酸盐菌的作用,将氨氮(以 NH4+表示,下同)氧化成硝酸盐,其反应的离子方程式为。
(2)MAP 沉淀法:向氨氮废水中投加磷酸盐和镁盐,使之和 NH4+生成难溶复盐MgNH4PO4·6H2O(简称MAP)结晶,是一种比较新颖有效的处理方法。
①用离子方程式表示反应的原理。
②MAP沉淀法需要控制反应的pH 在 7.5~10 之间。当 pH>10时,由于而不利于MAP的生成。
(3)电化学氧化法:电化学去除氨氮主要是氯气和次氯酸的间接氧化作用。对某养猪场废水进行电化学氧化处理,选用 IrO2-TiO2/Ti电极作为阳极,阴极采用网状钛板,加入一定量的NaCl,调节溶液的pH,在电流密度为 85 mA·cm-2下电解,180 min内去除率达到98.22%。
①阳极发生的电极反应式是 ; HClO 氧化除去氨氮的反应离子方程式是。
②为了提高氨氮的去除率,需要控制溶液中 Cl-的浓度和 pH,根据下图判断: Cl-的适宜浓度为,适宜的 pH 为。
五种短周期元素 A、B、C、D、E 的原子序数依次增大。A 的最高价氧化物与 B 的氢化物在水中反应得到的生成物既可与酸反应又可与碱反应。C、D 为金属元素,且 D 原子最外层电子数等于其 K 层电子数,而 C 的阳离子半径大于 D 的阳离子。若往 E 单质的水溶液中滴加少量紫色石蕊试液,能观察到先变红后褪色。请回答下列问题:
(1)C在元素周期表中的位置是E的氢化物的电子式为
(2)B和 E 的氢化物相互反应得到的产物中含有化学键的类型是
(3)A、E 元素形成的化合物的结构式是
(4)D 单质能与A的最高价氧化物反应,写出反应的方程式
【化学——选修3:物质结构与性质】
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的______区;溴的价电子排布式为________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是______(写出名称)。
| 氟 |
氯 |
溴 |
碘 |
|
| 第一电离能(kJ/mol) |
1681 |
1251 |
1140 |
1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图I、II所示: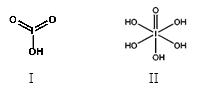
请比较二者酸性强弱:HIO3_____ H5IO6(填“>”、 “<”或“=”)。
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(6)下图为碘晶体晶胞结构。有关说法中正确的是_________。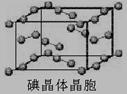
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见下图)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。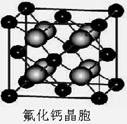
氨气常用作致冷剂及制取铵盐和氮肥,是一种用途广泛的化工原料。
(1)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
①曲线a对应的温度是。
②关于工业合成氨的反应,下列叙述正确的是(填字母)。
A.及时分离出NH3可以提高H2的平衡转化率
B.加催化剂能加快反应速率且提高H2的平衡转化率
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=" K(Q)" >K(N)
③M点对应的H2转化率是。
(2)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。
①当氨水中所含氨的物质的量为3 mol ,吸收标准状况下44.8 L SO2时,溶液中的溶质为。
②NH4HSO3溶液显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确的是(填字母)。
a.c(NH4+) = 2c(SO32-) + c(HSO3-)
b.c(NH4+)> c(SO32-)> c(H+)= c(OH-)
c.c(NH4+)+ c(H+)= c(SO32-)+c(HSO3-)+c(OH-)
(3)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:
①氨气燃料电池的电解质溶液最好选择(填“酸性”、“碱性”或“中性”)溶液。
②空气在进入电池装置前需要通过过滤器除去的气体是。
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方是。
在压强为0.1 MPa、10L恒容的密闭容器中,将2 mol CO与 5 mol H2的混合气体在催化剂作用下能生成甲醇:CO(g) + 2H2(g) CH3OH(g)ΔH<0请回答下列问题:
CH3OH(g)ΔH<0请回答下列问题:
(1)①该反应的熵变ΔS0(填“>”、“<”或“=”)。
②若温度T1 >T2,则平衡常数K(T1)K(T2)(填“大于”、“小于”或“等于”)
③下列措施既可加快反应速率又可增加甲醇产率的是;
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入2 mol CO和5 mol H2
④下列可说明反应已达到化学平衡状态的是________;
A.v生成(CH3OH)=v消耗(CO)
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.CO与H2浓度比不再变化
(2)若温度T2时,5min后反应达到平衡,CO的转化率为75%,则:
①平衡时体系总的物质的量为mol;
②反应的平衡常数K=;
③反应在0-5min区间的平均反应速率v(H2)=。