元素X的原子有3个电子层,最外层有4个电子。这种元素位于周期表的
| A.第4周期ⅢA族 | B.第4周期ⅦA族 |
| C.第3周期ⅣB族 | D.第3周期ⅣA族 |
下列图像表达正确的是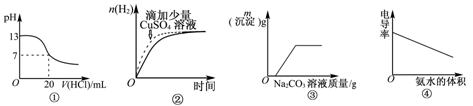
| A.图①表示25℃时,用0.1mol·L-1盐酸滴定20mL 0.1mol·L-1NaOH溶液 |
| B.图②表示常温下,两份足量、等浓度的盐酸与等量锌粉反应时,其中一份滴加了少量硫酸铜溶液 |
| C.图③表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 |
| D.图④表示向醋酸溶液中滴入氨水 |
下列各组物质发生化学反应时,由于反应物的量不同而生成不同产物的是
①CO2与NaOH溶液②NaHCO3溶液与盐酸③AgNO3溶液与氨水
④C与O2⑤AlCl3溶液与氨水
| A.除③外 | B.除②外 | C.除②③⑤外 | D.除②⑤外 |
一定条件下的密闭容器中:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)△H= ﹣905.9 kJ·mol-1,下列叙述正确的是
4NO(g)+6H2O(g)△H= ﹣905.9 kJ·mol-1,下列叙述正确的是
| A.4 mol NH3和5 mol O2反应,达到平衡时放出热量为905.9 kJ |
| B.平衡时v正(O2)="4/5" v逆(NO) |
| C.平衡后降低压强,混合气体平均摩尔质量增大 |
| D.平衡后升高温度,混合气体中NO含量降低 |
某合作学习小组讨论辨析以下说法正确的是
①粗盐和酸雨都是混合物
②沼气和水煤气都是可再生能源
③冰和干冰既是纯净物又是化合物
④不锈钢和目前流通的硬币都是合金
⑤盐酸和食醋既是化合物又是酸
⑥纯碱和熟石灰都是碱
⑦豆浆、雾、烟都是胶体
⑧利用丁达尔效应可以区分溶液和胶体
| A.①②③④⑥ | B.①③④⑦⑧ | C.③④⑤⑥⑦ | D.①②④⑤⑧ |
根据以下几个反应:
①Cl2+2KBr=2KCl+Br2②Br2+2KI=2KBr+I2
判断氧化性由强到弱的顺序是()
| A.I2>Br2>Cl2 | B.Cl2>Br2>I2 |
| C.Br2>I2>Cl2 | D.Cl2>I 2>Br2 2>Br2 |