有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,外电路电流由D到C;③A、C用导线相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D用导线相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺序是
A.A>C>D>B B.A>B>C>D
C.C>A>D>B D.C>B>D>A
下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应 设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40% NaOH溶液。下列叙述中正确的是
设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40% NaOH溶液。下列叙述中正确的是
| A.甲组操作时,电流计(G)指针发生偏转 |
| B.乙组操作时,C2做正极 |
| C.乙组操作时,C1上发生的电极反应为:I2+2e-===2I- |
| D.甲组操作时,溶液颜色变浅 |
下列解释实验事实的化学方程式正确的是
A.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀: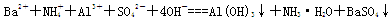 |
| B.KMnO4和H2O2在酸性条件下反应:2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O |
| C.在电解质溶液为氢氧化钾的甲醇燃料电池内电路中,负极的电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O |
| D.向NaAlO2溶液中通入过量CO2:CO2+3H2O+2AlO2-=2Al(OH)3↓+CO32- |
用H2O2和H2SO4的混合溶液可溶解废旧印刷电路板上的铜。已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=" +64.39" kJ·mol -1
2H2O2(l)═2H2O(l)+O2(g)△H= -196.46 kJ·mol -1
H2(g)+ 1/2O2(g)═H2O(l))△H=-285.84 kJ·mol -1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H2O(l)的反应热△H等于
| A.-417.91 kJ·mol -1 | B.-319.68 kJ·mol -1 |
| C.+546.69 kJ·mol -1 | D.-448.46 kJ·mol -1 |
已知H—H键键能为436 kJ/mol,H—N键键能为391 kJ/mol,根据化学方程式:N2(g)+3H2(g)===2NH3(g) ΔH=-92 kJ/mol,则N≡N的键能是
| A.431 kJ/mol | B.946 kJ/mol | C.649 kJ/mol | D.869 kJ/mol |
某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他电极均为Cu,则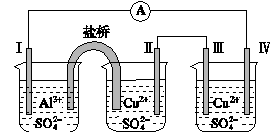
A.电流方向:电极Ⅳ→ →电极Ⅰ →电极Ⅰ |
| B.电极Ⅰ发生还原反应 |
| C.电极Ⅱ逐渐溶解 |
| D.电极Ⅲ的电极反应:Cu2++2e-=Cu |