哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生,有关说法正确的是
| A.达到化学平衡时,N2将完全转化为NH3 |
| B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
| C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 |
| D.达到化学平衡时,正反应和逆反应的速率都为零 |
下列说法正确的是()
| A.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 |
| B.燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 |
| C.要将溶解在CCl4中的碘单质分离出来,可以用蒸馏法,因为碘易升华,先分离出来 |
| D.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 |
下列各组物质相互混合反应后,最终有白色沉淀生成的是()
①金属钠投入到FeCl3溶液中
②过量NaOH溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中
④向Al Cl3溶液中滴入NaHCO3溶液
⑤向饱和Na2CO3溶液中通入足量CO2.
| A.①③④⑤ | B.只有①④ | C.只有②③ | D.只有③④⑤ |
如表所示的四种元素中,W、X、Y、Z均为短周期元素,其中Y是地壳中含量最高的元素,且这四种元素的原子最外层电子数之和为22,下列说法正确的是()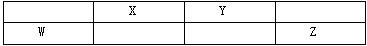
| A.X、Y、Z三种元素最低价氢化物的沸点依次升高 |
| B.由X、Z和氢三种元素形成的化合物中只有共价键 |
| C.原子半径的大小顺序:r(X)>r(Y)>r(W)>r(Z) |
| D.X的最高价氧化物对应的水化物的酸性比W的强 |
下列各组离子能在指定溶液中大量共存的是()
①无色溶液中:K+、Cl﹣、Na+、MnO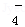 、NO
、NO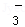 、SO42-
、SO42-
②pH=11的溶液中:CO2-3、Na+、AlO 、NO
、NO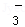 、S2﹣、SO
、S2﹣、SO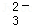
③酸性溶液中:Fe2+、Al3+、NO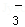 、I﹣、Cl﹣、S2﹣
、I﹣、Cl﹣、S2﹣
④加入Mg能放出H2的溶液中:Mg2+、NH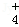 、Cl﹣、K+、SO
、Cl﹣、K+、SO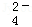 .
.
| A.①② | B.①③ | C.②④ | D.③④ |
用NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A.100 mL 1 mol/L的FeC13溶液完全生成Fe(OH)3胶体,其胶粒数目为0.1NA |
| B.7.8 gNa2O2中含有的离子总数目为0.4NA |
| C.标准状况下,44.8 L HF所含分子数为2NA |
| D.标准状况下,80 gSO3中所含的原子数为4NA |