某同学探究同周期元素性质递变规律时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
| 实验步骤 |
实验现象 |
| ①将一小块金属钠放入滴有酚酞的冷水中 |
A.剧烈反应,产生大量无色气体。 |
| ②将镁条用砂纸打磨后,放入沸水中,再向溶液中滴加酚酞溶液 |
B.浮在水面,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 |
| ③将镁条放入稀盐酸中 |
C.生成淡黄色沉淀。 |
| ④将铝条放入稀盐酸中 |
D.反应较快,产生无色气体。 |
| ⑤向AlCl3溶液中滴加NaOH 溶液至过量 |
E.有气体产生,溶液变成浅红色。 |
| ⑥向新制的Na2S溶液中滴加新制的氯水 |
F.产生白色胶状沉淀,继而沉淀消失。 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究同周期元素性质递变规律。
(2)实验药品:金属钠、镁条、铝条、稀盐酸、新制氯水、新制Na2S溶液、AlCl3溶液、NaOH 溶液等。
实验仪器:试管、试管夹、酒精灯、胶头滴管、镊子、小刀、玻璃片、砂纸等。
(3)实验内容(填写与实验步骤对应的实验现象的标号和化学方程式)
| 实验内容 |
实验现象 |
化学方程式 |
| ① |
B |
|
| ② |
|
Mg + 2H2O  Mg(OH)2 + 2H2 ↑ Mg(OH)2 + 2H2 ↑ |
| ③ |
|
Mg + 2HCl = MgCl2 + H2↑ |
| ④ |
D |
|
| ⑤ |
|
AlCl3 + 3NaOH = Al(OH)3↓+ 3NaCl Al(OH)3 + NaOH = NaAlO2 + 2H2O |
| ⑥ |
|
Na2S + Cl2 =" 2NaCl" + S↓ |
(4)实验结论: 。
(14分)过碳酸钠(Na2CO4)和稀硫酸反应的化学方程式为:2Na2CO4+2H2SO4=2Na2SO4+2CO2↑+O2↑+2H2O 某过碳酸钠样品中含有少量过氧化钠,甲、乙两位同学各称取质量
某过碳酸钠样品中含有少量过氧化钠,甲、乙两位同学各称取质量 为m的该样品,并用下图所示是仪器测定样品的纯度。仪器的连接顺序是:甲是①⑦③⑥④;乙是①②。请回答下列问题:
为m的该样品,并用下图所示是仪器测定样品的纯度。仪器的连接顺序是:甲是①⑦③⑥④;乙是①②。请回答下列问题: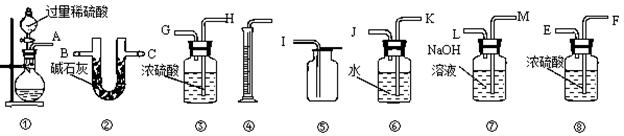
(1)甲同学想通过实验测得的数据是。他使用之中③______(填“有”或“没有”)必要。
(2) 乙同学想通过实验测得的数据是 。按他测得的数据计算出的实验结果_______(填“偏高”或“偏低”),理由是。
。按他测得的数据计算出的实验结果_______(填“偏高”或“偏低”),理由是。
(3). 为了测得准确的实验数据,请你将乙同学的实验装置进行改进(每种仪器只准使用一次),写出各仪器接的连接顺序。
(4). 按你设计的实验装置进行实验,若测得实验前后装置②的质量分别是w1和w2,则样品中过碳酸钠的质量分数为。
某强碱性溶液中可能含有的离子是K+、NH4+、Al3+、HCO3-、AlO2-、SO42-、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成.
②另取少量溶液逐滴加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)原溶液中肯定存在的离子是,肯定不存在的 离子是,不能确定的离子是,其检验方法是
离子是,不能确定的离子是,其检验方法是
。
(2)按照反应顺序逐步书写出②中发生反应的离子反应方程式①H++OH-=H2O
②。
③。
④HCO3-+H+=H2O+CO2↑
⑤。
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定
① 按上图组装仪器,检查装置的气密性;
② 将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③ 从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯;
④ 充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为。
(2)测的反应后装置B增重1.35g,则铁矿石中氧的质量百分含量为。
(3)若将H2换成CO,则还需补充装置。
(1)步骤④中煮沸的作用是。
(2)下列有关步骤⑥的操作中说法正确的是。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测夜润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色,再读数
(3)若滴定过程中消耗0.5000mol·L−1的KI溶液20.00mL,则铁矿石中铁的质量百分含量为 。
。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为。
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热。
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是。
(2)烧杯间填满碎纸条的作用是。
(3)大烧杯如不盖硬纸板,测得的中和热数值(填“偏大 ”、“偏小”或“无影响”)
”、“偏小”或“无影响”)
(4)实验中改用60mL 0.50mol/L盐酸跟50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”),简述理由。
(填“相等”或“不相等”),简述理由。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会(填“偏大”、“偏小”或“无影响”);用50mL 0.50mol/L NaOH溶液进行上述实验,测得的中和热的数值会(填“偏大”、“偏小”或“无影响”)。
(12分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH+6HCHO===3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察_______ 。
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由______________ 色变成____________色。
色变成____________色。
(2)滴定结果如下表所示:
| 滴定次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
| 滴定前刻度/mL |
滴定后刻度/mL |
||
| 1 |
25.00 |
1.02 |
21.03 |
| 2 |
25.00 |
2.00 |
21.99 |
| 3 |
25.00 |
0.20 |
20.20 |
若NaOH标准溶液的浓度为0.101 0 mol/L,则该样品中氮的质量分数为________。