(16分)I、为减少温室效应,科学家设计反应:CO2+4H2==CH4+2H2O以减小空气中CO2。
(1)若有1mol CH4生成,则有 mol σ键和 mol π键断裂。
(2)CH4失去H—(氢负离子)形成CH+3(甲基正离子)。已知CH+3的空间结构是平面正三角形,则CH+3中碳原子的杂化方式为 。
Ⅱ、金属原子与CO形成的配合物称为金属羰基配合物(如羰基铁)。形成配合物时,每个CO提供一对电子与金属原子形成配位键,且金属原子的价电子和CO提供的电子总和等于18。
(3)金属羰基配合物中,微粒间作用力有 (填字母代号)。
a、离子键 b、共价键 c、配位键 d、金属键
(4)羰基铁是一种黄色油状液体,熔点-21℃、沸点102.8℃。由此推测,固体羰基铁更接近于 (填晶体类型)。若用Fe(CO)x表示羰基铁的化学式,则x= 。
III.研究表明,对于中心离子为Hg2+等阳离子的配合物,若配位体给出电子能力越强,则配位体与中心离子形成的配位键就越强,配合物也就越稳定。
(5)预测HgCl42-与HgI42-的稳定性强弱,并从元素电负性的角度加以解释。
答:HgCl42-比HgI42-更 (填“稳定”或“不稳定”),因为 。
氮可以形成多种离子,如N3-、NH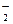 、N
、N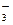 、NH
、NH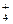 、N2H
、N2H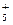 、N2H
、N2H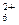 等,已知N2H
等,已知N2H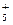 与N2H
与N2H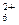 是由中性分子结合质子形成的,类似于NH
是由中性分子结合质子形成的,类似于NH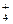 ,因此有类似于NH
,因此有类似于NH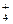 的性质。
的性质。
(1)NH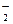 的电子式为__________。
的电子式为__________。
(2)N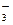 有__________个电子。
有__________个电子。
(3)写出两种由多个原子组成的含有与N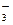 电子数相同的物质的化学式__________。
电子数相同的物质的化学式__________。
(4)等电子数的粒子往往具有相似的结构,试预测N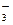 的构型____________________。
的构型____________________。
(5)据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是__________。
W、X、Y、Z四种短周期元素的原子序数X>W>Z>Y。W原子的最外层没有p电子,X原子核外s电子与p电子数之比为1∶1,Y原子最外层s电子与p电子数之比为1∶1,Z原子核外电子中p电子数比Y原子多2个。
(1)X元素的单质与Z、Y所形成的化合物反应,其化学方程式:________________________。
(2)W、X元素的最高价氧化物对应水化物的碱性强弱为__________<__________(用分子式表示)。
(3)这四种元素原子半径的大小为__________>__________>__________>__________(填元素符号)。
有第四周期的A、B、C、D四种元素,其价电子数依次为1、2、2、7,其原子序数依A、B、C、D依次增大。已知A与B的次外层电子数为8,而C与D为18。根据原子结构,判断:
(1)哪些是金属元素?__________。
(2)D与A的简单离子是 __________。
(3)__________元素的氢氧化物碱性最强。
(4)B与D的两原子间能形成的化合物是____________________(写出化学式)。
有机物
是最常用的食用油氧化剂,分子式为
,可发生如下转化:



 已知
的相对分子质量为60,分子中只含一个甲基。
的结构可表示为:
已知
的相对分子质量为60,分子中只含一个甲基。
的结构可表示为:

 请回答下列问题:
请回答下列问题: (1)根据系统命名法,
的名称为。
(1)根据系统命名法,
的名称为。 (2)官能团
的名称为,高聚物
的链节为。
(2)官能团
的名称为,高聚物
的链节为。 (3)
的结构简式为。
(3)
的结构简式为。 (4)反应⑤的化学方程式为。
(4)反应⑤的化学方程式为。 (5)
有多种同分异构体,写出期中2种符合下列要求的同分异构体的结构简式。
(5)
有多种同分异构体,写出期中2种符合下列要求的同分异构体的结构简式。 i.含有苯环 ii.能发生银镜反应 iii.不能发生水解反应
i.含有苯环 ii.能发生银镜反应 iii.不能发生水解反应 (6)从分子结构上看,
具有抗氧化作用的主要原因是(填序号)。
(6)从分子结构上看,
具有抗氧化作用的主要原因是(填序号)。 a.含有苯环 b.含有羰基c.含有酚羟基
a.含有苯环 b.含有羰基c.含有酚羟基
写出下列反应的化学方程式,是离子反应的写离子方程式。
(1)少量SO2气体通入到NaOH溶液中:____________。
(2)过量SO2气体通入到澄清石灰水中:___________。
(3)SO2气体通入到碘水中:_____________________。
(4)H2S气体与SO2气体混合:___________________。
(5)SO2和O2的反应:__________________________。
(6)SO2气体通入到少量Na2CO3溶液中____________