2012年8月24日,武汉市一家有色金属制造厂发生氨气泄露事故。已知在一定温度下,合成氨工业原料气H2制备涉及下面的两个反应:
C(s)+H2O(g) CO(g)+H2(g);
CO(g)+H2(g);
CO(g)+H2O(g) H2(g)+CO2(g)。
H2(g)+CO2(g)。
(1)判断反应CO(g)+H2O(g) CO2(g)+H2(g)达到化学平衡状态的依据是_____ ___。
CO2(g)+H2(g)达到化学平衡状态的依据是_____ ___。
A.容器内压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(2)在2 L定容密闭容器中通入1 mol N2(g)和3 mol H2(g),发生反应:3H2(g)+N2(g)  2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
①若图中c=1.6 mol,则改变的条件是________(填字母);
②若图中c<1.6 mol,则改变的条件是_ __(填字母);此时该反应的平衡常数_____(填“增大”、“减小”、“不变”)
A.升温 B.降温 C.加压 D.减压 E.加催化剂
(3)如图甲,平衡时氢气的转化率为________。
(4)工业上可利用如下反应:H2O (g)+CH4 (g)  CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如下图所示:0~4 s内,用H2 (g)表示的反应速率为____________,用CO(g)表示的反应速率为__________。
CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如下图所示:0~4 s内,用H2 (g)表示的反应速率为____________,用CO(g)表示的反应速率为__________。
已知有机物F和高分子N的合成路线如图所示:

(1)Q只含碳、氢、氧三种元素,且其碳、氢、氧元素质量比为9:1:6 ,经测定Q的相对分子质量是128。1 mol Q可与1 mol Br2加成,并能与1 mol NaHCO3恰好完全反应,且分子中无支链。Q的分子式是 。
(2)A所含官能团的名称是 、 ;A→B的反应类型是 ;
(3)写出C与银氨溶液反应的化学方程式: ;
(4)G的结构简式是 ;Q的反式结构简式是 。
(5)下列说法正确的是 。
| A.C能与苯酚在一定条件下生成高分子化合物 | B.D催化加氢的产物与F互为同分异构体 |
| C.F能发生氧化反应、取代反应、加成反应 | D.高分子N的每条分子链中含有(n-1)个酯基 |
(6)写出满足下列条件H的一种同分异构体的结构简式
①能与NaHCO3反应②能发生银镜反应③核磁共振氢谱有4个吸收峰
(7)写出H®N的化学方程式: 。
如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL1.0mol/L。
⑴A为(填“原电池”或“电解池”),其中Ag电极的电极反应式为:;发生反应(填“氧化”或“还原”)。
⑵B装置中的电极b极为极,电极反应式为,
总反应的化学方程式为。
⑶工作一段时间后,当Zn片质量减少6.5g时,a极逸出的气体在标准状况下的体积L。
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如下图所示。
(1)由图中的数据分析,该反应的化学方程式为;
(2)反应开始至2min时Z的平均反应速率为;
(3)下列关于化学反应速率与化学反应限度的叙述不正确的是 ( )
| A.反应限度是一种平衡状态,此时反应已经停止 |
| B.达到平衡状态时,正反应速率和逆反应速率相等 |
| C.达到平衡状态时,反应物和生成物浓度都不再改变 |
| D.化学反应速率理论是研究怎样在一定时间内快出产品 |
E.化学平衡理论是研究怎样使用有限原料多出产品
(4)5min后曲线的含义;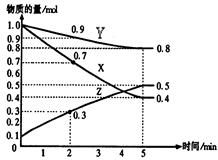
A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族.
(1)D在周期表中的位置;B的原子核外电子排布示意图;
(2)E元素形成最高价氧化物对应水化物的化学式为;
(3)元素C、D、E形成的原子半径大小关系是(用元素符号表示)。
(4)C、D可形成化合物D2C2,D2C2含有的化学键是;
(5)A、C两种元素形成的原子个数之比为1:1的化合物电子式;
(6)B的氢化物与B的最高价氧化物的水化物反应的离子方程式。
Ⅰ.按要求填空(每空1分)
①KOH的电子式:②NH4Cl的电子式:
③CO2的结构式:④HClO的结构式:
Ⅱ.按要求填空(每空2分)
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa(25℃时)时,已知0.5mol液态肼与足量氧气反应,生成氮气和水蒸气,放出312 KJ的热量。N2H4完全燃烧反应的热化学方程式是;又已知H2O(l)==H2O(g);△H = +44kJ∙mol-1,由64g液态肼与氧气反应生成液态水时放出的热量是kJ。