Ⅰ.按要求填空(每空1分)
①KOH的电子式: ②NH4Cl的电子式:
③CO2的结构式: ④HClO的结构式:
Ⅱ.按要求填空(每空2分)
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa(25℃时)时,已知0.5mol液态肼与足量氧气反应,生成氮气和水蒸气,放出312 KJ的热量。N2H4完全燃烧反应的热化学方程式是 ;又已知H2O(l)==H2O(g);△H = +44kJ∙mol-1,由64g液态肼与氧气反应生成液态水时放出的热量是 kJ。
KClO3和浓HCl在一定温度下反应会生成黄绿色的易爆物二氧化氯。其反应可表述为:
KClO3+HCl(浓)=KCl+ClO2+Cl2+H2O
(1)配平以上化学方程式(化学计量数填入划线上)并用双线桥标出电子转移的方向和数目。
(2)反应中的氧化剂是, ClO2是反应的(填氧化或还原)产物。
(3)反应产生0.1 mol Cl2,则转移的电子的物质的量为mol。
(4)ClO2具有很强的氧化性,因此可被用来做消毒剂,若ClO2作消毒剂后其自身转化为Cl-,则其消毒的效率(以单位物质的量得到电子数表示)是Cl2的倍。
t℃时,将3 mol A和1 mol B气体通人体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为;
(2)x=;
(3)若向原平衡混合物的容器中再充人a mol C,在t℃时达到新的平衡,此时B的物质的量为n(B)=
mol;
(4)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为。
Ⅰ. 在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系:
Cr2O72-+H2O  2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
(1)向上述溶液中加入NaOH溶液后,溶液呈色,因为。
(2)向已加入NaOH溶液的(1)中再加入过量稀H2SO4后,则溶液呈色,因为。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡向方向移动,溶液颜色将。(填“变深”、“变浅”或“不变”)
Ⅱ.实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
1.配制100mL 0.10mol/L NaOH标准溶液。
2.取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。
3.重复上述滴定操作2~3次,记录数据如下。
| 实验编号 |
NaOH溶液的浓度 (mol/L) |
滴定完成时,NaOH溶液滴入的体积(mL) |
待测盐酸溶液的体积 (mL) |
| 1 |
0.10 |
22.62 |
20.00 |
| 2 |
0.10 |
22.58 |
20.00 |
| 3 |
0.10 |
22.60 |
20.00 |
(1)滴定达到终点的现象是,此时锥形瓶内溶液的pH范围为。
(2)根据上述数据,可计算出该盐酸的浓度约为。
(3)排去碱式滴定管中气泡的方法应采用下图的操作,然后挤压玻璃球使尖嘴部分充满碱液。


甲乙丙
(4)在上述实验中,下列操作(其它操作正确)会造成测定结果偏高的有(多选扣分)。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中
E.配制NaOH标准溶液时,定容时仰视容量瓶的刻度线
F.碱式滴定管尖嘴部分有气泡,滴定后消失
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| a |
|||||||||||||||||
| b |
c |
d |
e |
f |
|||||||||||||
| g |
h |
i |
j |
k |
l |
m |
|||||||||||
| n |
o |
||||||||||||||||
试回答下列问题:
(1)请写出:元素o的基态原子电子排布式。
(2)k在空气中燃烧产物的分子构型为,中心原子的杂化形式为,该分子是(填“极性”或“非极性”)分子。
(3)含10电子的d的氢化物分子的VSEPR模型为。元素c、a、e按原子个数1:2:1组成生活中常见有甜味分子,该分子中有个手性碳原子。
(4)g、h、i三种元素的第一电离能由大到小的顺序为(填元素符号)。
(5)所有元素中电负性最大的是(填图中序号所示的元素符号),元素k有两种氧化物,它们对应的水化物的酸性强弱顺序为。(填化学式)
水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为;
(2)写出与H2O分子互为等电子体的微粒(填2种)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是;
| A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是
(请用相应的编号字母填写);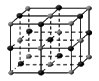
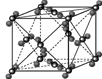

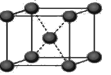
ABCDE
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键,已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式:。